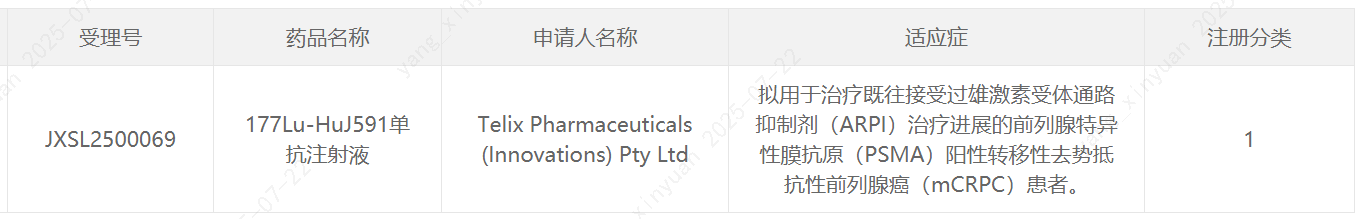
7月22日,中国国家药监局药品审评中心(CDE)官网公示,Telix Pharmaceuticals申报的1类新药177Lu-HuJ591单抗注射液获批临床,拟开发治疗既往接受过雄激素受体通路抑制剂(ARPI)治疗进展的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者。
公开资料显示,这是远大医药和Telix公司正在研发的一款放射性核素偶联药物(RDC) (研发代号:TLX591,177Lu rosopatamab tetraxetan)。本次获批临床的是一项前瞻性、随机、对照、开放标签、国际多中心的3期临床试验,拟在中国、美国、澳大利亚、新西兰等全球多个国家入组500余名患者,旨在评估TLX591联合标准治疗与仅接受标准治疗相比,在既往接受过ARPI治疗进展的mCRPC中的疗效和安全性。
据远大医药公开资料介绍,TLX591是一款携带治疗性放射性核素的单克隆抗体产品。其核心技术通过抗体精准定位与放射性核素递送系统实现双重突破:该产品以PSMA为靶点,利用单克隆抗体作为高特异性定位装置,搭载治疗性放射性核素177Lu精准输送至肿瘤部位,同时脱靶器官暴露率显著降低。相比其他长达六周期、持续30周的PSMA靶向放射性配体治疗(RLT)治疗,TLX591仅需间隔约14天的双剂给药方案,大幅缩短治疗周期,显著提升患者依从性,这一突破性设计解决了现有疗法治疗周期长、患者负担重的临床痛点。
基于独特的靶向递送机制和药理学特性,TLX591在安全性方面展现显著优势,通过肝脏代谢清除而非肾脏途径,长期随访未观察到显著的急性或延迟性肾毒性,突破传统RLT治疗中肾脏毒性的技术瓶颈。同时其大分子结构使其对唾液腺和泪腺的摄取率极低,减少口干症和干眼症等常见不良反应发生率,改善患者生活质量。当前前列腺癌治疗领域亟需辐射暴露更低的治疗方案,TLX591凭借其精准靶向特性和差异化药理学优势,已展现出超越现有抗PSMA小肽RLT分子的临床潜力。
此前,远大医药用于诊断前列腺癌的创新RDC产品TLX591-CDx已于2023年8月在中国完成3期临床试验首例患者给药,并计划于今年二季度完成全部患者入组。目前,该产品已在美国、澳大利亚、加拿大、巴西、英国、捷克、法国及多个欧洲经济区成员国获批上市。TLX591和TLX591-CDx这两项创新产品在中国的3期临床试验,对于实现前列腺癌“诊疗一体化”的全面覆盖具有关键意义。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..