编者按:2025年,美国FDA旗下的药物评价和研究中心(CDER)批准了46款创新药。作为创新赋能者、客户信赖的合作伙伴以及全球医药及生命科学行业的贡献者,药明康德将持续通过独特的“CRDMO”业务模式,助力更多合作伙伴,为全球病患带来突破性创新疗法。根据PDUFA的目标日期,预计2026年2月,美国FDA将对4款创新药物是否获批做出监管决定,本文将对这些疗法进行相关介绍。
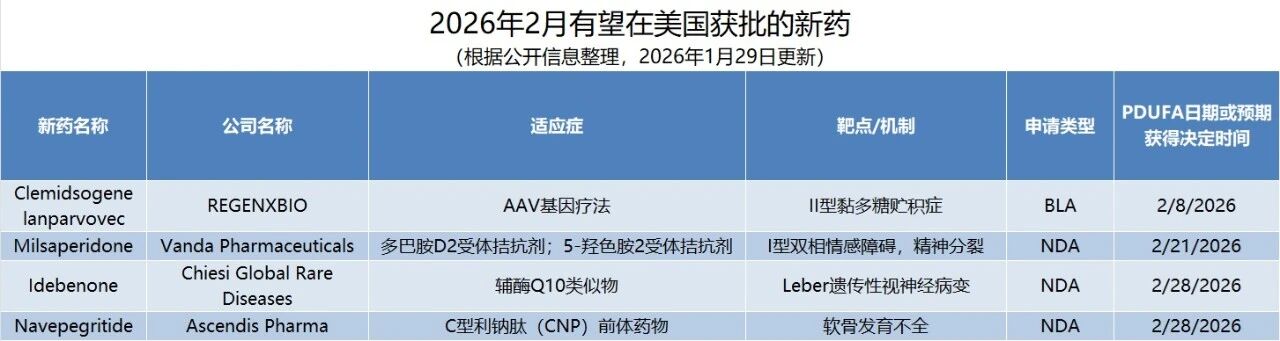
▲2月美国FDA可能批准的新药
活性成分:Clemidsogene lanparvovec
适应症:II型黏多糖贮积症(MPS II)
公司名称:REGENXBIO
Clemidsogene lanparvovec采用AAV9载体,将编码人艾杜糖酸-2-硫酸酯酶(IDS)的转基因递送至中枢神经系统(CNS)。向CNS细胞内递送编码IDS的转基因可以为患者提供一个持久的IDS分泌来源,并在中枢神经系统内发挥作用,实现对CNS中相关细胞功能缺陷的长期改善。
2025年9月公布的关键性试验数据表明,单次clemidsogene lanparvovec治疗可在12个月内持续改善患者结局。研究显示,患者脑脊液(CSF)中MPS II关键生物标志物HS D2S6水平下降超过80%,并维持一年,同时患者在神经发育相关功能方面表现出持续改善或稳定。试验在第16周达到主要终点,即脑脊液中HS D2S6水平显著降低。此外,一年随访结果显示,脑脊液中HS D2S6水平与神经发育结局显示出强相关性,从而支持HS D2S6作为预测临床获益的替代生物标志物。
活性成分:Milsaperidone
适应症:I型双相情感障碍(BP-I)和精神分裂症
公司名称:Vanda Pharmaceuticals
Milsaperidone是一种新化学实体,为iloperidone的前药。Vanda Pharmaceuticals发现,经口服给药后,milsaperidone可迅速转化为iloperidone(一种已上市抗精神病药物)。临床研究显示,在低剂量和高剂量下,无论是单次给药还是多次给药,milsaperidone与iloperidone的生物等效性均已被证实。
Milsaperidone在治疗BP-I相关的躁狂或混合发作,以及精神分裂症方面的疗效与安全性,获得了iloperidone说明书中所列举的临床研究的支持,包括两项急性精神分裂症发作研究、一项针对BP-I躁狂或混合发作的研究,以及一项精神分裂症复发预防研究。此外,它的安全性也得到了iloperidone临床研究中数千名患者数据的支持。Milsaperidone独特的物理和化学性质使其适合在未来开发为长效注射剂型。
Milsaperidone属于非典型抗精神病药物类别,同时作用于某些5-羟色胺和多巴胺受体,这些受体被认为与其治疗效应密切相关。
活性成分:Idebenone
适应症:Leber遗传性视神经病变(LHON)
公司名称:Chiesi Global Rare Diseases
Idebenone是一种泛醌(亦称辅酶Q10)的合成类似物,泛醌是细胞内重要的抗氧化剂,也是电子传递链(ETC)的关键组成部分。研究显示,idebenone可通过与ETC相互作用,提高线粒体功能所需的ATP生成,减少自由基,抑制脂质过氧化反应,从而保护脂质膜和线粒体免受氧化损伤。Chiesi Global Rare Diseases在2025年9月宣布,美国FDA接受为idebenone递交的新药申请(NDA)并授予其优先审评资格,用于治疗Leber遗传性视神经病变。Idebenone旨在靶向LHON的潜在病因——线粒体功能障碍,从而保护、维持并重新激活视网膜神经节细胞功能。
该申请获得随机、安慰剂对照试验数据,以及开放标签干预性和观察性研究数据的支持,这些研究在广泛的患者人群中证实了idebenone的疗效。在3期临床试验RHODOS中,主要疗效终点为最佳视力恢复(VA),定义为基线至第24周在改善最明显或恶化最小的那只眼中的视力变化,采用早期治疗糖尿病视网膜病变研究(ETDRS)视力表进行测量。结果显示,在改良的意向治疗(mITT)群体中,idebenone组(n=53)患者视力平均改善约6个ETDRS字母;安慰剂组(n=28)平均改善约1个ETDRS字母(p=0.0862)。
活性成分:Navepegritide
适应症:软骨发育不全
公司名称:Ascendis Pharma
Navepegritide是一种在研C型利钠肽(CNP)前体药物,每周给药一次,旨在提供患者活性CNP的持续暴露。C型利钠肽可通过阻断FGFR3的活性,就好像松开抑制儿童生长的“刹车”,直接靶向软骨发育不全的病理生理机制,从而促进软骨内骨形成,让患儿的生长速率恢复正常。
根据此前公布的3期ApproaCH试验结果,该研究已达成主要终点。数据显示,在第52周时,接受navepegritide治疗儿童(n=57)的最小二乘(LS)平均年化生长速度(AGV)为5.89厘米/年,而安慰剂组(n=27)患者的LS平均AGV为4.41厘米/年,两组间的LS平均差异为1.49厘米/年(p<0.0001)。进一步的亚组分析显示,接受navepegritide治疗的2至5岁儿童(n=21)在第52周时的LS平均AGV为6.07厘米/年,而安慰剂组(n=10)的LS平均AGV为5.06厘米/年,LS平均差异为1.02厘米/年(p=0.0084)。接受navepegritide治疗的5至11岁儿童(n=36)在第52周时的LS平均AGV为5.79厘米/年,而安慰剂组(n=17)的LS平均AGV为4.02厘米/年,LS平均差异为1.78厘米/年(p<0.0001)。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..