本期看点:
1. 抗半乳糖凝集素-9(galectin-9)单克隆抗体LYT-200用于治疗复发/难治性急性髓系白血病(AML)和高风险骨髓增生异常综合征(MDS),在一项早期临床试验中联合标准疗法,使患者的初步总生存期(OS)较同类患者延长近10个月。
2. 新型在研变构型BCR-ABL1抑制剂TERN-701在既往接受过治疗的慢性髓系白血病(CML)患者中取得令人鼓舞的1期临床试验数据,75%接受剂量>320 mg/天的患者在24周内达到主要分子学缓解(MMR)。
3. 创新BTK降解剂bexobrutideg(NX-5948)用于治疗复发或难治性慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL),早期临床试验数据积极,患者的总缓解率(ORR)达到83%。
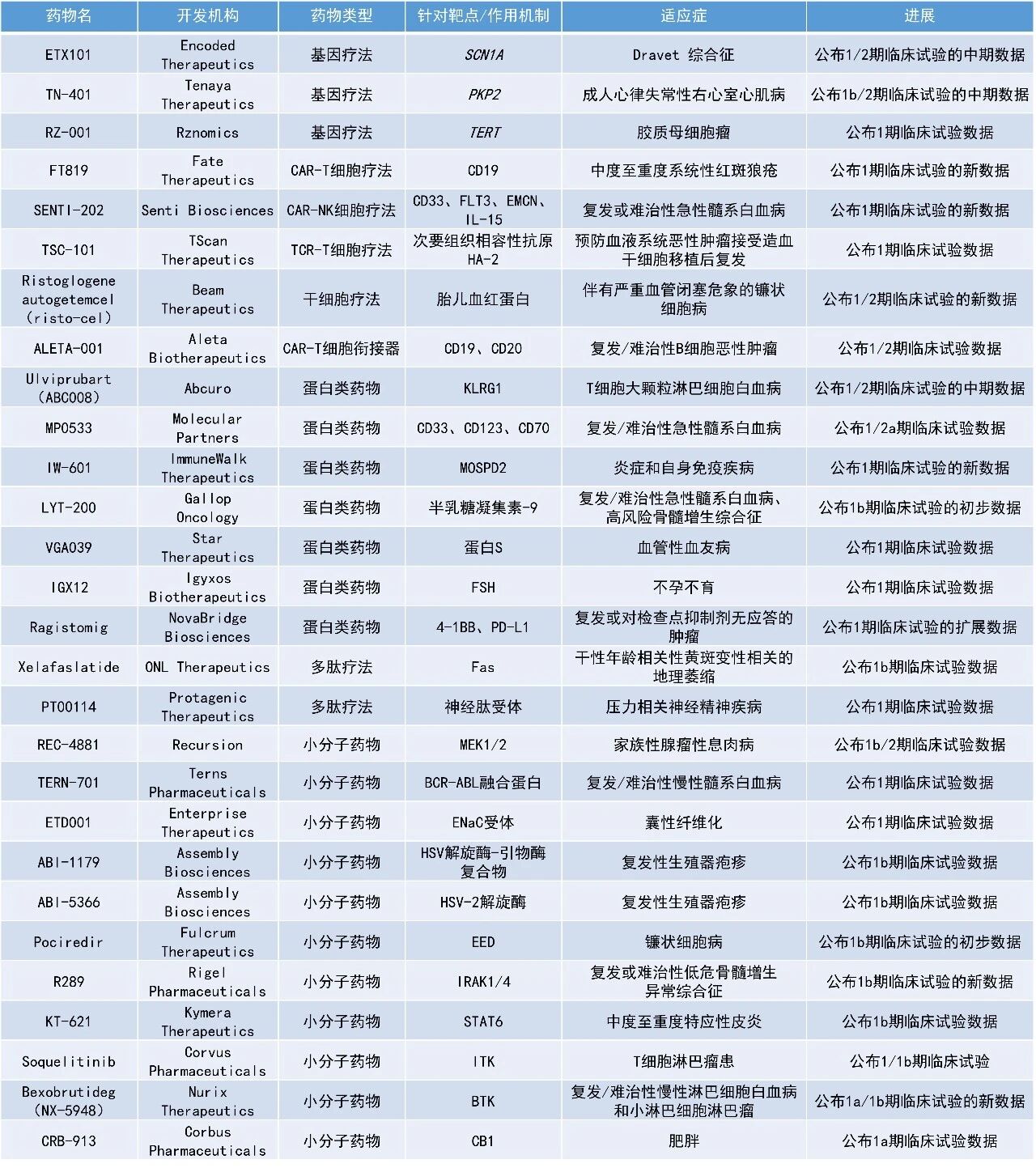
LYT-200:公布1b期临床试验的初步数据
Gallop Oncology公司公布了其在研药物LYT-200在1b期临床试验中的初步顶线数据。LYT-200是一种潜在“first-in-class”的抗半乳糖凝集素-9单克隆抗体,正在被评估用于治疗复发/难治性AML和高风险MDS患者。
该研究纳入了既往接受过多种治疗的晚期患者,旨在评估LYT-200作为单药或联合标准疗法的疗效与安全性。结果显示,LYT-200在推荐的2期剂量下表现出良好的耐受性和显著的抗肿瘤活性。在联合治疗组中,初步的中位OS达到13.2个月,远超此类晚期患者通常预期的<2.5个月的生存期。此外,LYT-200在携带高风险基因突变的患者中也观察到治疗应答,提示其可能具有广泛的适用人群。
TERN-701:公布1期临床试验数据
Terns Pharmaceuticals公司宣布,在正在进行的CARDINAL临床试验中,其新型在研变构型BCR-ABL1抑制剂TERN-701在既往接受过治疗的CML患者中展现出令人鼓舞的疗效和安全性数据。数据显示,在所有可评估疗效的患者中,64%在24周内达到MMR;而在剂量>320 mg/天的患者亚组中,这一比例提升至75%。此外,随着治疗时间延长,TERN-701继续保持良好的安全性和耐受性。
Bexobrutideg(NX-5948):公布1a/1b期临床试验的新数据
Nurix Therapeutics公司公布了其开发的创新BTK降解剂bexobrutideg,用于治疗复发或难治性CLL和SLL的积极早期临床试验数据。数据显示,1a期临床试验中,在47名可进行疗效评估的患者中,接受bexobrutideg治疗的患者的ORR达到83%,中位无进展生存期为22.1个月,中位缓解持续时间为20.1个月。值得一提的是,这些患者此前接受过多种治疗,包括共价和/或非共价BTK抑制剂。在1b期患者队列中,早期数据显示接受剂量为600 mg的bexobrutideg治疗的患者ORR为83.3%。Bexobrutideg在所有剂量水平下耐受良好,符合先前披露的研究结果。
Pociredir:公布1b期临床试验的初步数据
Fulcrum Therapeutics公司公布了其在研疗法pociredir在镰状细胞病(SCD)患者中开展的1b期PIONEER临床试验的初步结果。Pociredir是一种靶向胚胎外胚层发育蛋白(EED)的口服小分子抑制剂。通过抑制EED,pociredir可有效下调关键的胎儿珠蛋白阻遏蛋白(包括BCL11A),从而导致胎儿血红蛋白(HbF)水平升高。
此次公布的结果显示,在第6周时,20 mg剂量组患者的平均绝对HbF水平较基线增加9.9%;其中58%(7/12)的患者HbF水平≥20%。截至2025年11月11日的数据,在完成第12周访视的患者中(n=6),20 mg组HbF平均诱导倍数>3.75倍。此外,研究还观察到泛细胞型HbF诱导、溶血和贫血标志物改善,以及血管阻塞危象(VOC)减少的积极趋势。Pociredir总体耐受性良好,未报告与治疗相关的严重不良事件(SAEs)。
KT-621:公布1b期临床试验数据
Kymera Therapeutics公司宣布,其在研口服、潜在“first-in-class”的STAT6降解剂KT-621在BroADen特应性皮炎(AD)临床1b期试验中取得积极结果。结果显示,在100 mg和200 mg剂量组中,KT-621在皮肤和血液中分别实现了中位94%和98%的STAT6降解。同时,KT-621在血液中显著降低多项与疾病相关的2型炎症生物标志物水平,包括TARC(中位下降74%)、Eotaxin-3、IL-31和IgE,并在皮损中下调核心2型炎症及与AD相关的基因。
在临床疗效方面,KT-621在多项疾病评估终点上均表现出强劲疗效,所有患者平均湿疹面积和严重度指数(EASI)评分降低63%,瘙痒NRS峰值评分平均降低40%。对于合并哮喘的患者,中位部分呼出一氧化氮(FeNO)水平下降56%,哮喘控制获得有意义改善;合并过敏性鼻炎的患者在症状及生活质量方面也获得显著获益。安全性方面,KT-621耐受性良好,未报告严重不良事件或治疗相关不良事件,未出现结膜炎病例,生命体征、实验室检查及心电图亦未见临床相关异常。
REC-4881:公布1b/2期临床试验数据
Recursion公司宣布,其在研变构型MEK1/2抑制剂REC-4881在家族性腺瘤性息肉病(FAP)患者中开展的1b/2期TUPELO临床试验取得积极数据。自然病程分析显示,在55例未接受治疗、且符合TUPELO试验入组标准的FAP患者中,87%的患者每年息肉负荷呈增加趋势,10%保持稳定,仅有3%出现轻微减少,展现了该疾病的进行性发展特征。
此次公布的结果显示,接受REC-4881 4 mg/天治疗的患者在12周内即展现出快速临床活性:在12例可评估患者中,75%出现结肠息肉负荷减少,中位减少幅度达43%。停药12周后(研究第25周),11例可评估患者中有9例(82%)仍维持疗效,息肉负荷较基线中位减少53%。此外,40%的患者(4/10)实现Spigelman分期改善≥1分,表明上消化道疾病严重程度减轻。安全性方面,REC-4881的安全性特征与MEK1/2抑制一致,大多数治疗相关不良事件为1级或2级,未报告4级及以上的治疗相关不良事件。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..