据 Insight 数据库统计,11 月份(11.1-11.27),有 9 款国产新药首次进入 III 期临床阶段,开始向上市申请发起冲刺。
从药物类型来看,包括 7 款化药和 2 款生物药。本文将从中选择部分项目跟大家分享。如欲了解更多新药启动临床情况,可以扫描文末二维码,前往 Insight 数据库查询。
11 月首次进入 III 期的国产新药
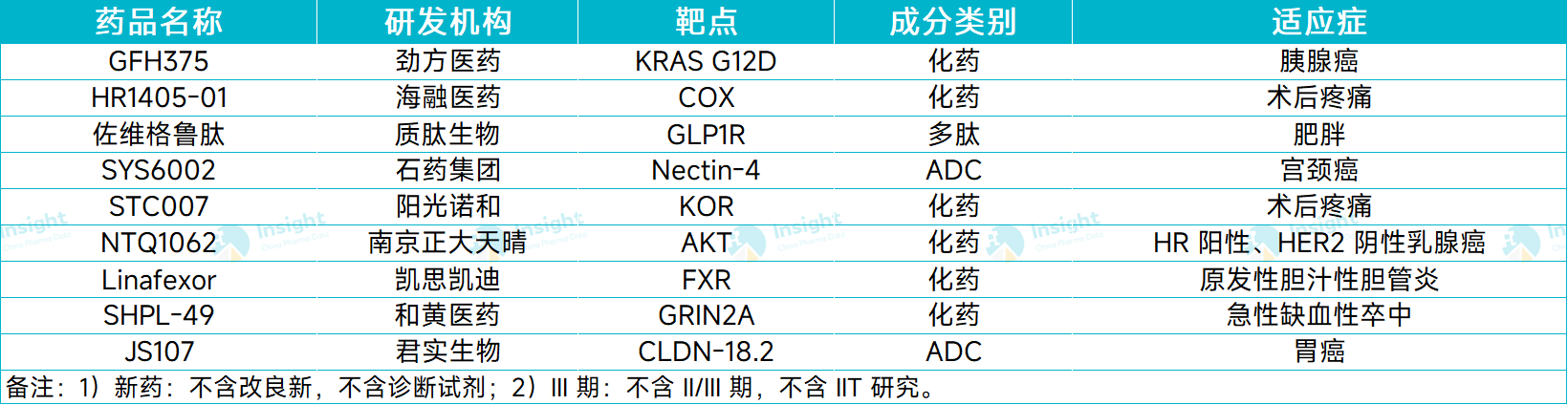
图片来源:Insight 数据库整理(数据统计时间:11.1-11.27)
石药集团
Nectin-4 ADC
11 月 17 日,石药集团启动了一项随机、开放标签、对照、多中心 III 期临床试验,旨在比较 SYS6002 与医生选择的化疗方案在接受含铂化疗和抗 PD-(L)1 药物治疗后复发或转移性宫颈癌中的疗效。研究的主要终点是 OS。
SYS6002 是一种靶向 Nectin-4 的新一代 ADC,包含一个位点特异性可裂解连接子,并以 MMAE 作为有效载荷,DAR 为 2。
2022 年 11 月,石药集团在中国内地启动该药的首个人体试验。2024 年 ASCO 大会上公布的初步疗效结果显示,在 2.7 mg/kg 及以上剂量 SYS6002 组中未确认的 ORR 达到 50%,其中宫颈癌患者的 ORR 达到67%(2/3)。
2023 年 3 月,石药集团与 Corbus Pharmaceuticals, Inc. 就 SYS6002 的开发及商业化订立独家授权协议,交易总金额近 7 亿美元。次年,双方启动了一项 I/II 期临床试验,目前该试验正在美国和欧洲进行。
Insight 数据库显示,目前全球范围内仅有辉瑞/安斯泰来 1 款 Nectin-4 ADC(维恩妥尤单抗)获批上市。除此之外,还有 3 款已经进入临床 III 期阶段,分别来自石药集团、恒瑞医药和迈威生物。
质肽生物
GLP1R 激动剂
11 月 17 日,质肽生物在国内启动一项多中心、随机、双盲、安慰剂对照、平行组 III 期研究,旨在评估佐维格鲁肽对超重或肥胖成年人的疗效和安全性。
佐维格鲁肽(ZT002)是全球首个每月仅需皮下注射一次的 GLP-1 受体激动剂多肽,通过独有的双脂肪酸链修饰设计,显著增强了分子与白蛋白的结合能力,其亲和力约为司美格鲁肽的 10 倍,从而实现了超长的药物半衰期,支持每月给药一次。
2025 年欧洲糖尿病研究协会(EASD)年度会议上,质肽生物公布了其每月一次给药的新型超长效 GLP-1 受体激动剂(GLP-1 RA)佐维格鲁肽的 II 期研究数据,研究达成了主要终点。
结果显示,佐维格鲁肽 80 mg Q4W 组、160 mg Q4W 组、80 mg Q2W 组和 160 mg Q2W 组至 24 周的疗效均优于安慰剂组(体重较基线变化的百分比分别为-10.6%、-13.8%、-12.5% 和-14.4% vs. -2.4%,p 值均<0.0001),且未观察到疗效平台期;至 24 周体重较基线下降≥5% 的受试者比例分别为 89.9%、97.1%、93.6% 和 93.9% vs. 13.0%。
企业新闻稿指出,佐维格鲁肽治疗 24 周的体重降幅在数值上优于同靶点药物司美格鲁肽 2.4 mg,与替尔泊肽 15 mg 相当。
此外,佐维格鲁肽四个剂量组的安全性和耐受性均良好,整体胃肠道不良事件发生率与已上市 GLP-1 RA 类药物相近。
君实生物
CLDN-18.2 ADC
11 月 26 日,君实生物在中国内地启动了一项多中心、随机、对照、开放的 III 期临床研究,旨在评估 JS107 对比研究者选择治疗作为 CLDN18.2 阳性的晚期胃或胃食管结合部腺癌(G/GEJA)的二线或以上治疗的有效性和安全性。
JS107 是君实生物自主研发的注射用重组人源化抗 CLDN18.2 单克隆抗体 MMAE 偶联剂。在 2025 年 AACR 大会,君实以口头报告的形式首次公布了 JS107 单药或联合治疗晚期实体瘤患者的 I 期临床研究数据。
单药治疗方面,截至 2025 年 3 月 23 日,共入组 40 例 CLDN18.2 阳性 G/GEJA 患者,其中 26 例为 CLDN18.2 高表达:
阳性患者中,JS107 2.0 或 3.0 mg/kg Q3W 单药治疗,ORR 为 31.4%(11/35 例),DCR 为 83.3%(29/35 例);mPFS 为 4.1 个月,mOS 为 9.6 个月。
CLDN18.2 高表达患者中,ORR 和 DCR 分别为 34.8%(8/23 例)和 82.6%(19/23 例);mPFS 和 mOS 分别达到 4.1 个月 和 16.3 个月。
联合用药方面,CLDN18.2 阳性 G/GEJA 患者接受 JS107+特瑞普利单抗+XELOX 一线治疗,ORR 为 73.3%(22/30 例),DCR 为 96.7%(29/30 例);CLDN18.2 高表达患者中,ORR 和 DCR 分别达 81.0%(17/21 例)和 100%。
Insight 数据库显示,目前全球范围内尚未有 CLDN-18.2 ADC 获批上市,进度最快的已经进入临床 III 期阶段,全部来自国内企业,包括君实、乐普生物、信达、恒瑞等。
中国生物制药
AKT 抑制剂
11 月 21 日,中国生物制药旗下南京正大天晴在国内启动一项随机、双盲、对照 III 期临床试验,旨在评价 AKT 抑制剂 NTQ1062 联合氟维司群相对于安慰剂联合氟维司群在既往接受过内分泌治疗,且伴 PIK3CA /AKT1 /PTEN 改变的 HR+/HER2- 乳腺癌人群中的抗肿瘤疗效和安全性。主要终点是 PFS。
根据 Insight 数据库统计,目前南京正大天晴共有 5 款新药推进至临床阶段,分别是 AKT 抑制剂 NTQ1062(临床 III 期)、CFB 抑制剂 NTQ5082(临床 III 期)、AKL 抑制剂 NTQ2494(临床 I 期)、 MAT2A 抑制剂 NTQ3617(临床 I 期)和 IGF1R 单抗 NTB003(临床 I 期)。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..