云顶新耀EVM14中美双获批
10月13日,专注于创新疗法的发现、临床开发、生产和商业化的生物制药公司云顶新耀宣布,其肿瘤相关抗原(TAA)肿瘤疫苗EVM14的新药临床试验申请 (IND)已获得NMPA的批准。EVM14成为公司首个实现国家药监局(NMPA)和美国食品药品监督管理局 (FDA) IND双获批的mRNA肿瘤治疗性疫苗。
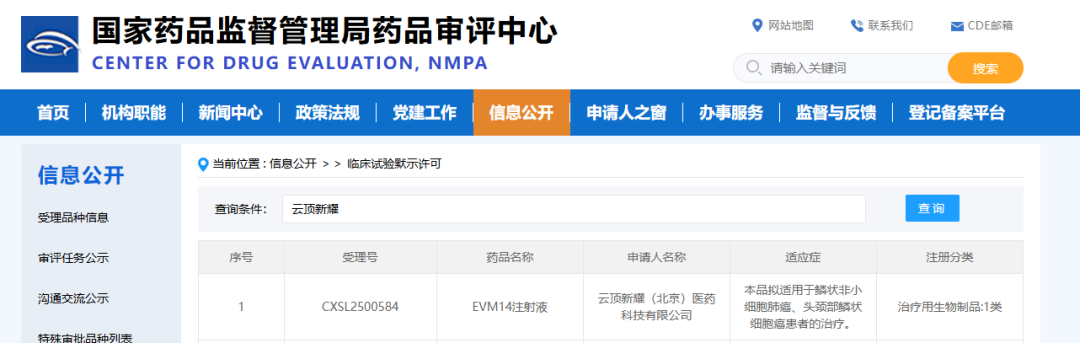
截图来源:CDE官网
公开资料显示,EVM14基于云顶新耀自主知识产权的mRNA技术平台研发,是一款靶向5个TAA的通用现货型肿瘤治疗性疫苗,拟用于治疗多种鳞状细胞癌,包括非小细胞肺鳞癌(sq-NSCLC)和头颈部鳞状细胞癌(HNSCC)。
此前,EVM14新药临床试验申请于2025年3月获FDA批准。此次获批的I期临床试验主要目的是观察EVM14的安全性和耐受性,次要目的是观察其疗效。在EVM14 I期临床试验探索的瘤种中,大多数患者会表达5个TAA之一。其中,约96%的sq-NSCLC患者和97%的HNSCC患者检测到至少一个TAA基因的表达。
艾伯维1类新药国内申报上市
10月13日,国家药品监督管理局药品审评中心 (CDE)官网显示,艾伯维注射用E型肉毒毒素(TrenibotE)上市申请获受理,注册分类为1类。根据公开资料和临床试验进展,推测其适应症为中度至重度眉间纹。
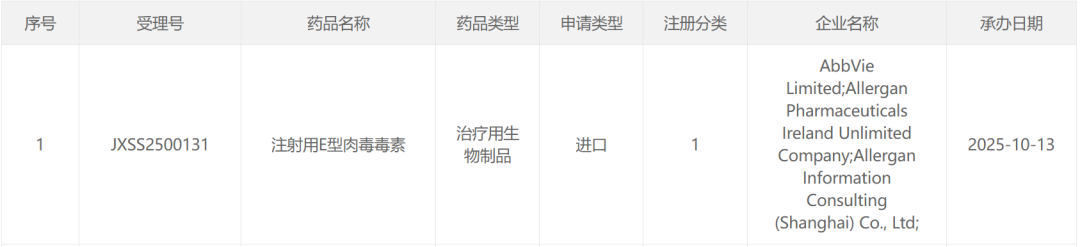
截图来源:CDE 官网
公开资料显示,TrenibotE是同类首创的E型肉毒神经毒素,2025 年4月,艾伯维向FDA提交了该产品的首个上市申请,此申请得到来自2100多名接受TrenibotE治疗患者的临床研究数据支持,其中包括两项评估TrenibotE治疗中度至重度眉间纹的关键性Ⅲ期临床研究(M21-500和M21-508)以及一项Ⅲ期开放标签安全性研究(M21-509)。
以上Ⅲ期研究的所有主要和次要终点均已达到,给药后8小时即可快速起效(最早评估时间),且疗效持续时间为2~3周。
此外,无论是作为单次治疗还是最多连续三次治疗,TrenibotE治疗中出现的不良事件与安慰剂相似。在国内,艾伯维曾针对该产品启动一项治疗中度至重度皱眉纹的Ⅲ期多中心随机安慰剂对照研究,具体研究结果尚未披露。
赣州和美药业1类新药获批上市
10月11日,NMPA官网显示,赣州和美药业申报的1类新药莫米司特片获批上市,为国内获批的首款自主研发的PDE4小分子创新药,为斑块状银屑病(PS)患者带来新的治疗选择。

截图来源:国家药监局官网
公开资料显示,莫米司特片(Hemay005片)是和美药业开发的一款磷酸二酯酶4(PDE4)小分子抑制剂,可通过调节细胞内cAMP和/或cGMP水平控制下游多种炎症因子的产生,在多种炎症相关疾病中均有不错的治疗效果。
据悉,莫米司特片于2016年12月首次进入临床阶段,目前已在国内登记了10余项临床试验;2023年7月,莫米司特片完成中重度斑块状银屑病适应症的Ⅲ期临床试验,并于2024年4月提交新药生产上市注册申请 (NDA)。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..