本期看点
1. Revolution Medicines公司宣布了daraxonrasib(RMC-6236)的1期临床试验的积极初步结果,无论是单药治疗还是联合化疗方案,daraxonrasib在一线转移性胰腺导管腺癌(PDAC)患者中均展现出积极疗效。
2. p53靶向潜在“first-in-class”小分子rezatapopt(PC14586)的早期临床试验结果亮眼,在八种肿瘤类型中均观察到确认的治疗应答。
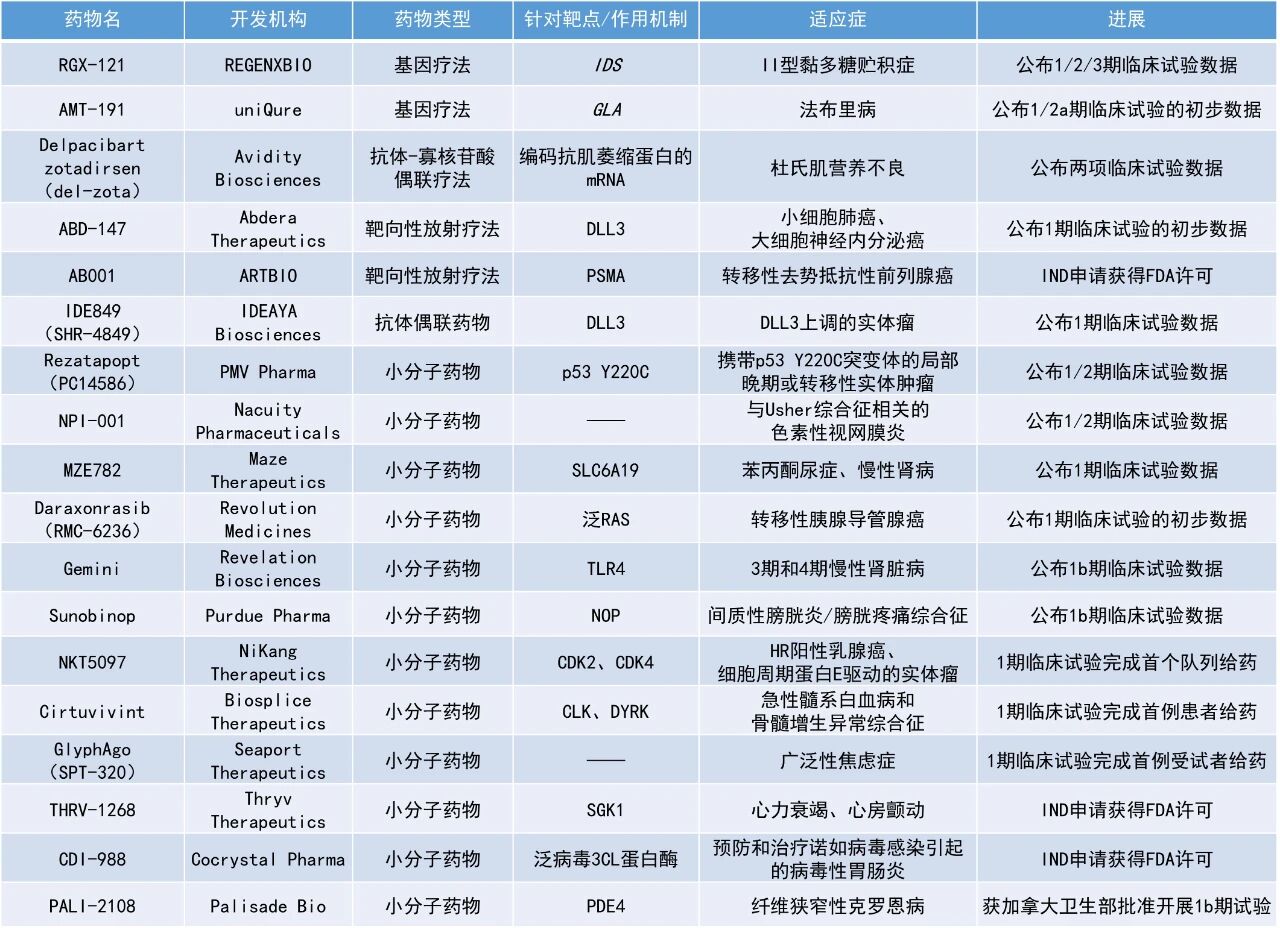
Daraxonrasib(RMC-6236):公布1期临床试验的初步数据
Revolution Medicines公司宣布了其RAS(ON)多重选择性抑制剂daraxonrasib(RMC-6236)的1期临床试验的最新进展。Daraxonrasib是一款口服选择性抑制剂,能够靶向处于GTP结合(激活、ON)状态的突变型及野生型RAS蛋白。该疗法曾在2025年6月获美国FDA授予突破性疗法认定,用于治疗既往接受治疗、携带KRAS G12突变的转移性PDAC患者。
此次公布的结果显示,在二线及以上(2L+)转移性PDAC患者中,接受每日一次(QD)300 mg daraxonrasib治疗的患者表现出良好的耐受性,安全性与既往数据一致。疗效方面,携带RAS G12X突变或携带任何RAS突变患者,其确认客观缓解率(ORR)分别为35%与29%,疾病控制率(DCR)则分别为92%与95%,中位无进展生存期(PFS)约8.5个月与8.1个月,中位总生存期(OS)达13.1与15.6个月。
在一线转移性PDAC患者中,daraxonrasib 300 mg QD单药治疗的总体耐受性良好。在具足够随访时长的38例患者中,ORR达47%,DCR达89%,中位随访时间为9.3个月。Daraxonrasib联合吉西他滨和白蛋白紫杉醇(GnP)的组合方案在一线转移性PDAC中展现出更高的缓解率。研究选用daraxonrasib 200 mg QD联合标准剂量的GnP给药。结果显示,在40例RAS突变患者中,安全性良好,未出现新的信号;在具有足够随访时长的31例患者中,ORR达到55%,DCR为90%,中位随访时间为6.9个月。这些数据为公司计划于2025年第四季度启动的3期临床试验提供了有力支持。
Rezatapopt(PC14586):公布1/2期临床试验数据
PMV Pharmaceuticals公司公布了其PYNNACLE关键性临床1/2期试验中,2期部分的中期数据。该试验旨在评估rezatapopt(PC14586)在携带TP53 Y220C突变的晚期实体瘤患者中的疗效。Rezatapopt是一款潜在“first-in-class”的小分子p53再激活剂,能够选择性结合p53 Y220C突变蛋白的特定口袋,从而恢复其野生型抑癌功能。
中期结果显示,该药物在卵巢癌、肺癌、乳腺癌、子宫内膜癌、头颈癌、结直肠癌、胆囊癌及壶腹癌等八种肿瘤类型中均观察到确认的治疗应答。在全部97例可评估患者中,总缓解率达到33%,中位缓解持续时间为6.2个月。在卵巢癌亚组的44例可评估患者中,总缓解率达到43%,中位缓解持续时间为7.6个月。基于这些积极结果,公司计划于2027年第一季度提交rezatapopt用于治疗铂类耐药或复发性卵巢癌的新药申请(NDA)。
MZE782:公布1期临床试验数据
Maze Therapeutics公司宣布,其口服小分子药物MZE782在针对健康受试者的1期临床试验中取得积极结果。MZE782是一种靶向溶质转运蛋白SLC6A19的口服小分子,具备成为苯丙酮尿症(PKU)“best-in-class”疗法,以及慢性肾脏病(CKD)“first-in-class”疗法的潜力。该药物通过抑制SLC6A19蛋白功能,减少苯丙氨酸(Phe)从肠道的吸收和在肾脏的重吸收,从而能降低血浆Phe水平,有望为PKU患者提供一种不受基因型限制的新疗法。对于CKD,MZE782通过减轻SLC6A19介导的重吸收引起的肾近端小管的超负荷代谢,有望延缓疾病进展,其机制与SGLT2抑制剂不同且可以互补。
此次公布的结果显示,所有单递增剂量(SAD)和多递增剂量(MAD)组均观察到剂量依赖性的尿氨基酸排泄增加。在240 mg每日两次剂量队列中,观察到第7天24小时内尿Phe排泄量增加了42倍。该指标是经过充分验证的PKU生物标志物,且对CKD具有预测价值。MZE782还表现出与SGLT2抑制剂类似的剂量依赖性初始估算肾小球滤过率(eGFR)下降,提示其可能具有肾脏保护作用。此外,该药物的安全性和耐受性良好,未报告严重不良事件。
Sunobinop:公布1b期临床试验数据
Purdue Pharma公司宣布,其针对间质性膀胱炎/膀胱疼痛综合征(IC/BPS)的在研新药sunobinop的1b期临床研究取得了积极的初步结果。IC/BPS是一种慢性、痛苦的泌尿系统疾病,严重影响患者的生活质量。Sunobinop是一种潜在“first-in-class”的口服化合物,旨在结合并激活广泛存在于中枢和外周神经系统中的伤害感受素/孤啡肽FQ肽受体(NOP),该受体参与多种生理功能调节。
此次公布的结果显示,在双盲治疗期结束时,接受sunobinop治疗的患者中有41%报告其整体IC/BPS症状(包括膀胱疼痛减轻、尿急和尿频减少、单次排尿量增加)出现显著或中度改善,而安慰剂组的改善率仅为9%。安全性方面,没有死亡、严重不良事件或因不良事件而停用sunobinop的报告。研究中观察到的最常见的不良事件是尿路感染和嗜睡。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..