本期看点
1. 罗氏(Roche)靶向淀粉样蛋白的单克隆抗体trontinemab的早期临床试验结果亮眼,持续显示出快速且显著的淀粉样蛋白斑块清除效果。
2. Zymeworks公司潜在“first-in-class”的新型glypican-3(GPC3)靶向抗体偶联药物(ADC)ZW251获美国FDA批准进入临床。
3. Fulcrum Therapeutics公司治疗镰状细胞病(SCD)的口服胚胎外胚层发育(EED)小分子抑制剂pociredir在一项1b期临床试验中使患者的胎儿血红蛋白(HbF)水平显著提升。
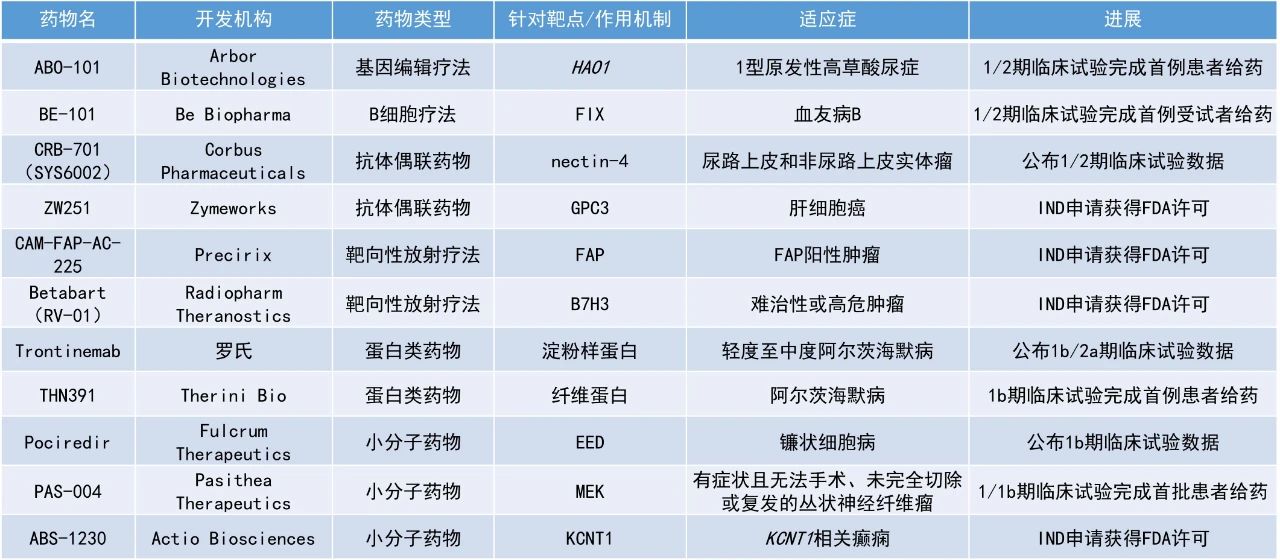
Trontinemab:公布1b/2a期临床试验数据
罗氏公布了其在研抗体trontinemab在1b/2a期阿尔茨海默病(AD)研究Brainshuttle AD中的最新积极数据。Trontinemab是一款运用罗氏大脑穿梭(brain shuttle)技术的靶向淀粉样蛋白单克隆抗体。该药物将靶向淀粉样蛋白的单抗与能结合转铁蛋白受体的蛋白结构域融合,从而协助其穿越血脑屏障,在用药3-6个月后可以快速有效地清除大脑中的淀粉样蛋白沉积。
这次所公布的是trontinemab用于治疗阿尔茨海默病患者Brainshuttle AD研究第2部分(剂量扩展部分)的最新结果。分析显示,trontinemab持续显示出快速且显著的淀粉样蛋白斑块清除效果,其中91%的受试者在淀粉样蛋白正电子发射断层扫描(PET)评估中转为阴性,且与水肿/渗出相关的淀粉样蛋白成像异常(ARIA-E)发生率保持在5%以下。
ZW251:IND申请获得FDA许可
Zymeworks公司宣布,其在研新药ZW251的IND申请已获得美国FDA批准。ZW251是一款潜在“first-in-class”的新型GPC3靶向抗体偶联药物,搭载了公司专有的拓扑异构酶1抑制剂(TOPO1i)载荷ZD06519,用于治疗肝细胞癌(HCC)。HCC是最常见的原发性肝癌类型,其中超过75%的病例表达GPC3。ZW251由人源化IgG1抗体通过经验证的可裂解肽连接子,与新型喜树碱类TOPO1i载荷偶联而成。该药物选择了药物-抗体比(DAR)为4的设计,较低的DAR有助于在更广泛的剂量范围内进行探索,这对常伴有肝功能受损的慢性肝病和肝硬化HCC患者具有潜在优势。在临床前研究中,ZW251在多种HCC模型中表现出强效抗肿瘤活性,并且在非人灵长类动物毒理学研究中显示出良好的耐受性。
Pociredir:公布1b期临床试验数据
Fulcrum Therapeutics公司公布了其口服EED小分子抑制剂pociredir治疗镰状细胞病的1b期PIONEER试验的积极结果。通过抑制EED,pociredir可有效下调关键的胎儿珠蛋白阻遏蛋白(包括BCL11A),从而导致HbF水平升高。Pociredir已获得美国FDA授予的快速通道资格和孤儿药资格,用于治疗SCD。
Pociredir在治疗12周时表现出具有临床意义的HbF提升效果,HbF的绝对值水平较基线平均提升8.6%,16例患者中有7例的HbF绝对值水平>20%。F细胞(含HbF的红细胞)比例从基线时的平均34%上升至治疗12周时的67%。此外,溶血关键标志物有显著改善,总血红蛋白(Hb)平均提升0.9 g/dL。与基线相比,血管闭塞危象(VOC)的发生频率也呈现出令人鼓舞的下降趋势。安全性方面,pociredir总体耐受性良好,未报告与治疗相关的严重不良事件(SAE),所有与治疗相关的不良事件(AE)均为1级。
ABS-1230:IND申请获得FDA许可
Actio Biosciences公司宣布,其在研新药ABS-1230的IND申请已获得美国FDA批准,并被授予快速通道资格。此外,该药物也已获得澳大利亚人类研究伦理委员会(HREC)的有条件批准,允许开展人体临床评估。ABS-1230是一款潜在“first-in-class”的口服小分子抑制剂,用于治疗KCNT1相关癫痫。在临床前研究中,ABS-1230能有效抑制所有测试过的KCNT1致病突变体,表明其具有治疗所有KCNT1相关癫痫患者的潜力。该药设计为每日一次的口服片剂或溶液,相较需临床输注的疗法更具便利性。Actio公司计划于2025年秋季启动ABS-1230的1期临床试验(健康受试者部分),并拟于2026年初扩展至针对KCNT1相关癫痫患者的1b期概念验证研究。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..