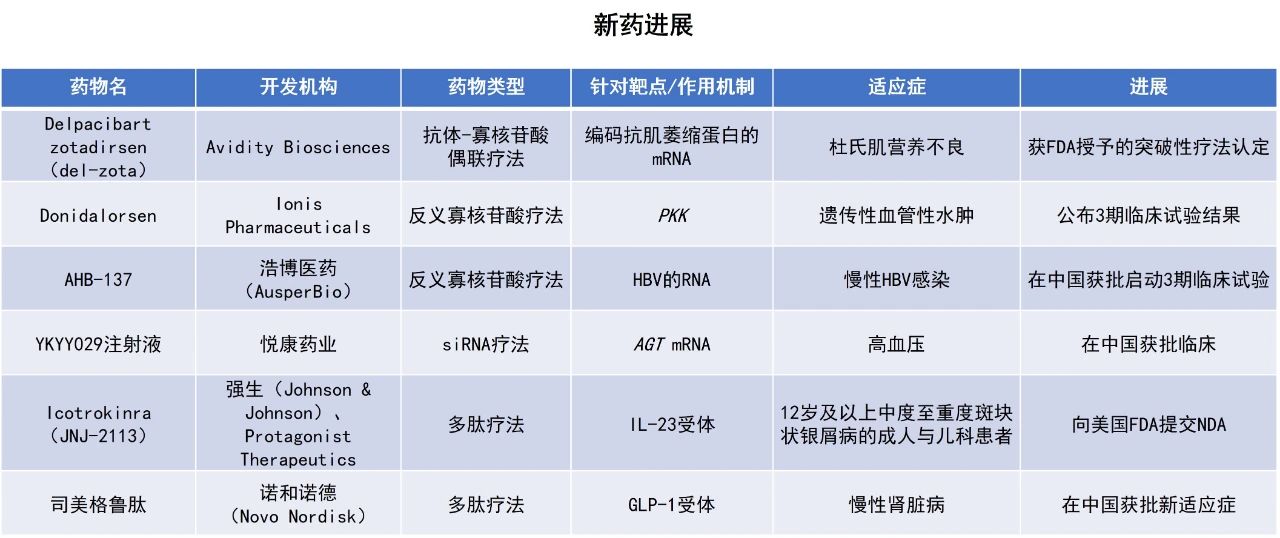
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。浩博医药旨在治疗慢性乙型肝炎以实现功能性治愈的反义寡核苷酸(ASO)疗法AHB-137在中国获批启动3期临床试验。Avidity Biosciences公司用于治疗杜氏肌营养不良(DMD)的在研疗法delpacibart zotadirsen(del-zota)获得美国FDA授予的突破性疗法认定,公司计划在2025年年底按计划向FDA提交上市申请。Ionis Pharmaceuticals公司用于治疗遗传性血管性水肿(HAE)的在研ASO疗法donidalorsen的3期临床试验结果积极,有望近期获FDA批准上市。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
AHB-137:在中国获批启动3期临床试验
浩博医药宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已批准AHB-137启动3期临床试验。AHB–137是一种ASO疗法,旨在治疗慢性乙型肝炎以实现功能性治愈。该疗法通过与乙肝病毒的RNA精准匹配,招募肝细胞中的酶摧毁来自病毒的RNA,从而中止乙肝病毒的复制和病毒蛋白的产生。此次3期临床试验为一项在中国开展的随机、双盲、多中心研究,旨在评估治疗为期24周、剂量300 mg的AHB-137在接受稳定核苷(酸)类似物治疗的乙型肝炎e抗原(HBeAg)阴性慢性乙型肝炎患者中的疗效与安全性。
浩博医药此前新闻稿表示,AHB-137治疗可以使乙型肝炎表面抗原(HBsAg)快速下降并诱导较高的乙肝表面抗体转阳。AHB-137在临床2b期试验中展现出令人振奋的有效性数据和良好的安全性数据,进一步确认了其在2a期试验中展现的临床疗效。此次3期临床试验的获批,是浩博医药向实现慢性乙肝临床治愈目标迈出的关键一步。
Delpacibart zotadirsen(del-zota):获FDA授予的突破性疗法认定
Avidity Biosciences公司宣布,其用于治疗DMD的在研疗法del-zota获得了美国FDA授予的突破性疗法认定,用于治疗适用于外显子44跳跃治疗的杜氏肌营养不良(DMD44)患者。该疗法目前正在进行2期EXPLORE44开放标签延伸试验(EXPLORE44-OLE)。Avidity预计将在2025年年底按计划向FDA提交生物制品许可申请(BLA)。
之前公布的研究结果显示,剂量为5 mg/kg和10 mg/kg的del-zota均表现出强有力的骨骼肌递送能力,骨骼肌中寡核苷酸水平达到200 nM。外显子44跳跃效率显著增加40%。抗肌萎缩蛋白生成显著增加,平均增加至正常水平的25%,最高达到正常水平的58%。肌酸激酶水平下降至接近正常水平,相比基线减少了超过80%。
Del-zota由靶向1型转铁蛋白受体(TfR1)的单克隆抗体和促进编码抗肌萎缩蛋白的mRNA前体产生外显子44跳跃的寡核苷酸偶联而成,TfR1在肌肉组织中高度表达。这款疗法通过改变mRNA剪接过程,产生几乎与正常抗肌萎缩蛋白功能相同的蛋白。靶向TfR1的单克隆抗体可以通过与肌肉细胞表面的受体相结合,增强寡核苷酸的肌肉特异性递送。
Donidalorsen:公布3期临床试验结果
Ionis Pharmaceuticals公司宣布,其用于治疗遗传性血管性水肿的在研ASO疗法donidalorsen在3期OASISplus研究中取得积极结果。作为一种靶向前激肽释放酶(PKK)的在研ASO疗法,donidalorsen旨在通过抑制PKK的生成来预防HAE急性发作。Donidalorsen目前正在接受美国FDA的审评,以作为HAE的潜在“first-in-class”预防性治疗药物,该申请的PDUFA日期为8月21日。
研究中,患者依照预设的标准化方案从原有治疗过渡至donidalorsen,在此过程中未观察到疾病发作增加。治疗16周后,患者的平均HAE发作频率相较于既往治疗进一步显著降低。血管性水肿控制测试(AECT)评分亦显示,药物切换后报告疾病控制良好的患者比例从67%升至93%,不论使用哪种既往治疗,患者的生活质量评估也获得普遍改善。
Icotrokinra(JNJ-2113):向美国FDA提交NDA
强生(Johnson & Johnson)与Protagonist Therapeutics公司宣布,已向美国FDA提交新药申请(NDA),寻求批准其在研、每日一次口服多肽疗法icotrokinra(JNJ-2113)上市,用于治疗12岁及以上中度至重度斑块状银屑病(PsO)成人与儿科患者。Icotrokinra是一款潜在“first-in-class”的靶向口服多肽,能够选择性阻断IL-23受体(IL-23R)。IL-23在中度至重度斑块状PsO的致病性T细胞活化中起着关键作用,是PsO和其他皮肤病、风湿病和IL-23介导肠胃病中炎症反应的基础。Icotrokinra能够以个位数的皮摩尔亲和力与IL-23R结合,并对人类T细胞中的IL-23信号转导产生强效的选择性抑制作用。
此次申请包括四项关键的3期临床研究数据,这些研究均为ICONIC临床开发项目的一部分,包括ICONIC-LEAD、ICONIC-TOTAL以及ICONIC-ADVANCE 1和ICONIC-ADVANCE 2。Icotrokinra在上述3期研究中成功达成所有主要终点与共同主要终点,在12岁及以上中度至重度PsO成人与儿科患者中,显示出显著的皮肤症状清除效果和良好的安全性。
司美格鲁肽:在中国获批新适应症
诺和诺德(Novo Nordisk)宣布,NMPA正式批准了司美格鲁肽注射液新增慢性肾脏病(CKD)适应症。这是一款胰高血糖素样肽‑1(GLP-1)受体激动剂,目前该产品已经获批用于降低伴有慢性肾脏病的2型糖尿病成人患者估算肾小球滤过率(eGFR)持续下降、终末期肾病和心血管死亡的风险。
司美格鲁肽注射液此前已在中国获批用于饮食运动、二甲双胍和/或磺脲类药物治疗后血糖不达标的成人2型糖尿病(T2DM),及降低T2DM合并心血管疾病患者的主要心血管不良事件风险,并在心血管结局试验SUSTAIN 6研究中展现出潜在肾脏保护作用:可降低T2DM合并心血管疾病或高风险患者的肾脏复合事件风险达36%。
YKYY029注射液:在中国获批临床
悦康药业宣布,YKYY029注射液获得临床试验默示许可,拟开发治疗高血压。这是悦康药业子公司悦康科创和杭州天龙自主开发的AGT基因靶向小干扰RNA(siRNA)药物,具有全新的序列。
YKYY029注射液作为一款siRNA药物,其独特之处在于偶联了悦康药业研发的GalNAc递送系统,能够实现高效的肝靶向递送。该产品通过siRNA的干扰沉默机制,从源头靶向沉默AGT mRNA,有效阻断AGT蛋白的合成。AGT蛋白为肾素-血管紧张素-醛固酮系统(RAAS)的上游蛋白,抑制其表达将从根本上抑制RAAS系统升高血压的作用,从而降低血压。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..