本期看点
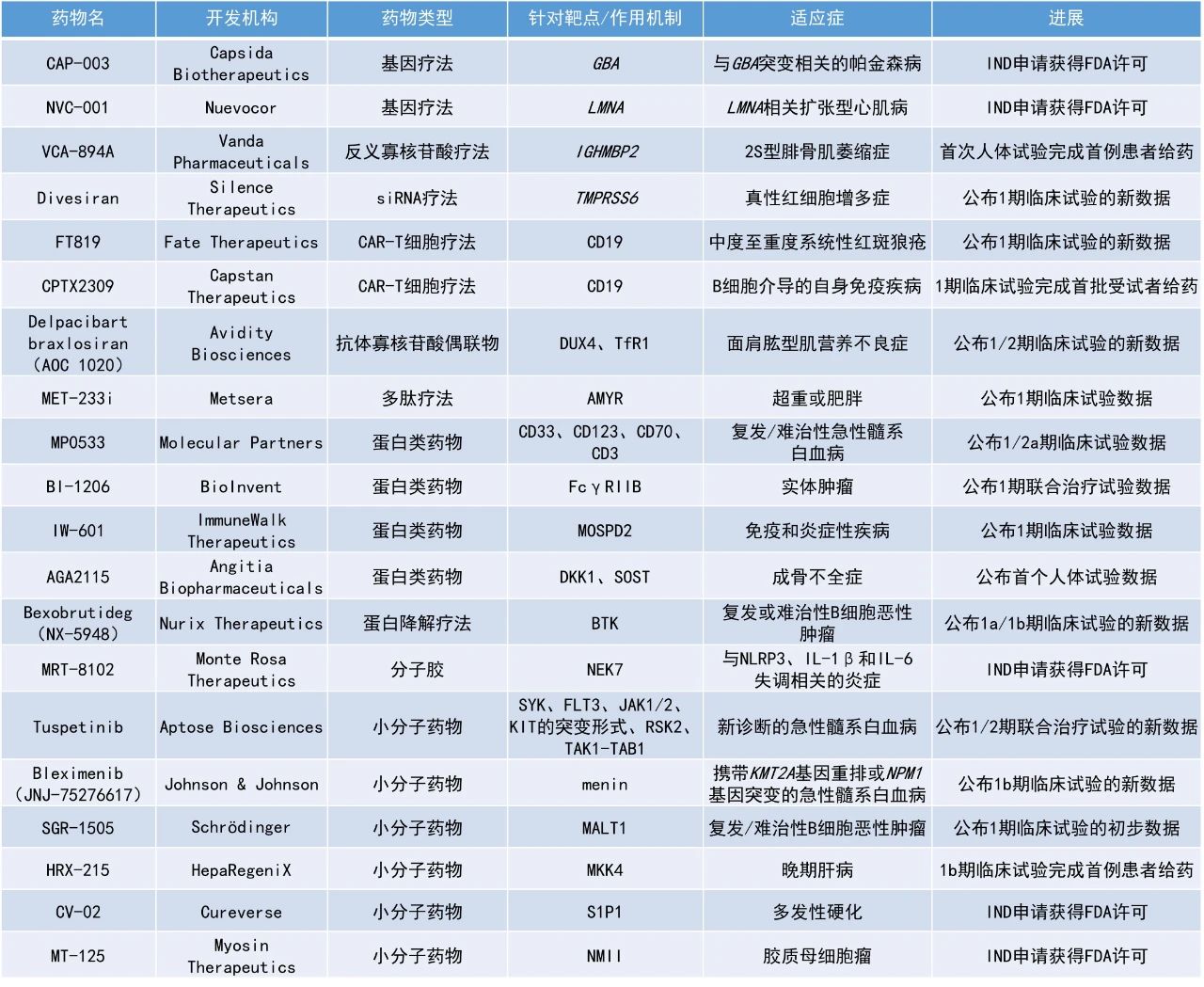
Bleximenib(JNJ-75276617):公布1b期临床试验的新数据
强生公司公布了其在研药物bleximenib的1b期临床试验的积极数据。Bleximenib是一种口服menin抑制剂,通过阻断menin与KMT2A融合蛋白之间的致癌相互作用,抑制携带KMT2A基因重排或NPM1基因突变的白血病细胞生长。该研究评估了bleximenib联用VEN+AZA在复发/难治性(R/R)AML和新确诊但不适合强化化疗的AML患者中的安全性和有效性。
该研究共纳入125名患者,其中52例携带KMT2A重排,73例携带NPM1突变。在推荐的2期剂量(RP2D)下,R/R AML患者的ORR为82%,cCR率为59%。新确诊但不适合强化化疗的AML患者的ORR为90%,cCR率为75%。安全性方面,数据显示分化综合征的发生率低,且无QTc间期延长的心脏安全信号。
Bexobrutideg(NX-5948):公布1a/1b期临床试验的新数据
Nurix Therapeutics公司公布了其布BTK降解剂bexobrutideg单药治疗复发/难治性CLL和WM患者的1a/1b期临床试验的新数据。Bexobrutideg是一种口服、可穿越血脑屏障的小分子BTK蛋白降解剂。
截至2025年3月12日,中位随访时间为9.0个月,大多数患者仍在接受治疗。在疗效可评估的47名CLL患者中,客观缓解率为80.9%,首次缓解的中位时间为1.9个月。许多患者在更长的时间内经历了缓解加深,多次从病情稳定转变为部分缓解(PR),一名接受治疗两年多的患者经历了完全缓解。中位缓解持续时间尚未达到,有18名患者接受了一年多的治疗。在所有CLL患者群体中观察到缓解,无论既往治疗、基线突变或中枢神经系统(CNS)受累如何。
在疗效可评估的19名WM患者中,客观缓解率为84.2%,包括2例非常好的部分缓解(VGPR)、11例PR和3例轻微缓解(MR)患者,3名患者获得疾病稳定(SD)。无论基线时MYD88突变和CXCR4突变的情况如何,患者均观察到缓解。此外,从4周的第一次评估开始就观察到关键疗效指标IgM水平的稳步下降,随后继续加深,3例患者的IgM水平降低超过90%。安全性方面,bexobrutideg耐受性良好,在较长的研究持续时间或更高的剂量下未观察到新的安全信号。
Tuspetinib:公布1/2期联合治疗试验的新数据
Aptose Biosciences公司公布了其针对新确诊的AML患者开展的1/2期TUSCANY试验的新数据。这些患者接受了不同剂量的tuspabetinib联用标准剂量的venetoclax和azacitidine(TUS+VEN+AZA三联疗法)。该三联疗法正在被开作发为一种安全且不依赖于特定突变的一线治疗方案,用于治疗那些无法接受诱导化疗的新确诊AML患者,这些患者具有多样的突变。
此次公布的结果显示,携带不同突变(包括TP53突变/复杂核型、FLT3野生型)的AML患者安全地达到了CR和最小残留病(MRD)阴性。40毫克剂量组(n=4)中有3名患者达到CR且MRD状态为阴性。80毫克剂量组(n=3)中所有3名患者均达到了CR和伴有血液学不完全恢复的完全缓解(CRi)。120毫克剂量组(n=3)的患者仍在接受治疗。安全性方面,该三联疗法的安全性良好,无治疗相关死亡,迄今为止接受治疗的所有10名患者均存活。
MP0533:公布1/2a期临床试验数据
Molecular Partners公司公布了其四特异性T细胞接合器MP0533用于治疗R/R AML患者的1/2a期临床试验的最新积极数据。MP0533是一种新型多特异性蛋白分子,可同时靶向CD33、CD123、CD70和CD3四个靶点。
截至2025年4月14日的数据,队列8中8名可评估的R/R AML患者中,有3人(超过30%)在第一个治疗周期后达到临床缓解,其中包括1例CR和2例伴有部分血液学恢复的完全缓解(CRh)。两名患者的缓解持续时间超过3个月,一名患者仍在接受治疗,缓解已维持超过6个月。安全性方面,MP0533在所有队列中均显示出可接受的安全性特征。
SGR-1505:公布1期临床试验的初步数据
Schrödinger公司宣布其候选药物SGR-1505在针对复发/难治性B细胞恶性肿瘤患者的1期临床试验中展现出积极的初步数据。SGR-1505是一种口服MALT1抑制剂,靶向NF-κB信号通路中的关键节点MALT1,旨在阻断癌细胞的存活与增殖。在临床前研究中,观察到SGR-1505具有高效性和选择性,并且在临床前模型中作为单一疗法以及与BTK抑制剂和BCL-2抑制剂联用均显示出抗肿瘤活性。
截至2025年5月13日,49名患者进行了安全性评估,SGR-1505整体安全且耐受性良好,未出现剂量限制毒性或因治疗伴发不良事件(TEAE)导致的死亡,常见不良事件包括皮疹和疲劳。45名疗效可评估的患者中,ORR为22%,并在多个B细胞肿瘤类型中观察到缓解,包括CLL/小淋巴细胞白血病(SLL)、WM和边缘区淋巴瘤(MZL)。值得注意的是,一些曾接受过BTK和BCL-2抑制剂治疗失败的患者也出现了缓解。目前,该研究正扩展至侵袭性淋巴瘤患者,并观察到1名患者达到PR。
HRX-215:1b期临床试验完成首例患者给药
HepaRegeniX公司宣布其候选药物HRX-215的1b期临床试验已完成首例患者给药。该试验旨在评估HRX-215在因结直肠癌肝转移而接受部分肝切除术的患者中的安全性和有效性。HRX-215是一种口服的小分子抑制剂,靶向肝脏再生过程中的关键调节因子丝裂原活化蛋白激酶激酶4(MKK4)。通过选择性地抑制MKK4,HRX-215已在临床前模型中被证明可以稳定和保护肝细胞,并加速和增强肝脏再生过程,即使是在受损或患病的肝脏中也同样有效。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..