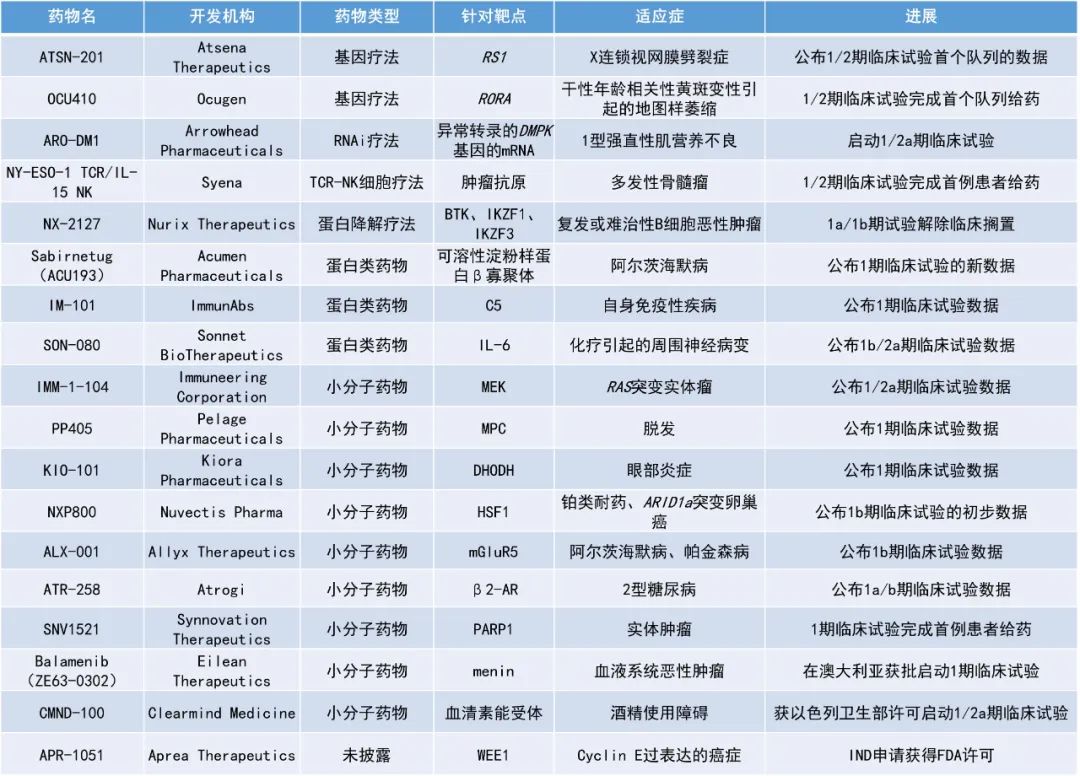
1. 新型局部外用小分子疗法PP405的早期临床结果表明,该疗法能重新激活休眠的毛囊干细胞,诱发毛发生长,有望治疗各类型脱发。
2. 第三代小分子MEK抑制剂IMM-1-104用于治疗晚期携带RAS突变的实体肿瘤患者的早期临床结果亮眼,100%的患者未产生获得性RAS变异,超半数患者观察到靶病灶的消退。
3. 口服HSF1信号通路抑制剂NXP800用于治疗铂类耐药、携带ARID1a突变的卵巢癌患者的1b期试验结果积极,疾病控制率达100%。
药明康德内容团队整理
PP405:公布1期临床试验数据
Pelage Pharmaceuticals公司公布了其新型局部外用小分子疗法PP405的转化研究和1期临床研究的积极数据。PP405是一种强效的局部线粒体丙酮酸载体(MPC)抑制剂,可作用于细胞代谢通路以上调乳酸脱氢酶(LDH)。干细胞对LDH尤为敏感,LDH的上调能够激活干细胞并促进毛发生长。
此次公布的数据证明该公司的新型局部外用小分子疗法PP405能重新激活休眠的毛囊干细胞,诱发毛发生长。在接受过面部提升去皱手术的皮肤上,单次外用0.006%和0.06%的PP405可在24小时内提高毛囊干细胞的LDH活性。LDH活性与毛发隆起处Ki67信号的显著增加相对应,表明毛囊干细胞有增殖反应。此外,1期研究还在雄激素性脱发患者中证明了机理和靶点作用。仅在0.05% PP405局部治疗7天后,Ki67信号与基线相比就出现了具有统计学意义的升高。研究人员还观察到新生毛基质(毛发生长周期中由休止期向生长期转变的标志)。
Pelage公司将于2024年中期启动PP405的多中心2a期临床试验,招募患有雄激素性脱发的男女患者。PP405还可用于其他类型的脱发,包括休止期脱发(由压力引起的脱发)和化疗引起的脱发。
IMM-1-104:公布1/2a期临床试验数据
Immuneering公司宣布,其高选择性第三代小分子MEK抑制剂IMM-1-104治疗晚期携带RAS突变的实体肿瘤患者的1/2a期试验取得了积极的顶线结果。IMM-1-104是一款靶向MAPK通路中重要激酶MEK的抑制剂,旨在通过每日一次给药对MAPK通路进行抑制。
这次所公布的试验共有41位患者入组,其中胰腺癌患者占63.4%、结直肠癌患者占12.2%、肺癌患者占9.76%。试验中有82%的患者在接受过往治疗时未曾达到部分缓解(PR)或完全缓解(CR)。截至2024年2月20日的数据,IMM-1-104在41例受试者中的耐受性良好,且具有差异化的安全性。
22名接受循环肿瘤DNA(ctDNA)检测并接受IMM-1-104治疗的可评估患者中,100%未出现新的获得性RAS变异,支持其具有泛RAS活性。在每天320 mg或240 mg剂量组中,53%的患者观察到靶病灶的消退。在二线治疗中,320 mg剂量组的最佳的患者肿瘤病变消退为-35.7%,240 mg剂量组中为-11.4%;320 mg剂量组的最佳RECIST肿瘤最长直径之和(SLD)减少了18.9%,240 mg剂量组中减少了7.1%。候选的推荐2期剂量(RP2D)为每日一次320 mg,该RP2D得到耐受性、ctDNA、药代动力学(PK)和药效(PD)特征和初始抗肿瘤活性等积极结果的支持。
NXP800:公布1b期临床试验的初步数据
Nuvectis Pharma公司公布了其开发的口服HSF1通路小分子抑制剂NXP800用于治疗铂类耐药、携带ARID1a突变的卵巢癌患者的1b期临床试验的积极结果。HSF1是一款应激诱导的转录因子,HSF1信号通路在肿瘤发生中起到重要作用,是多项研究验证的抗癌药物靶点。在针对多种类型的晚期实体肿瘤患者开展的1a期试验中,NXP800的临床概况与临床前实验的预期高度一致,没有报告与药物相关的4级或5级事件。此前,NXP80在铂类耐药、携带ARID1a突变卵巢癌中的开发项目已被美国FDA授予快速通道资格。
此次公布的结果显示,3名可评估患者的疾病控制率为100%,缓解率为33%。其中,1名达到未确认的PR患者的淋巴结非靶病灶获得了CR。
ATSN-201:公布1/2期临床试验首个队列的数据
ATSN-201是Atsena Therapeutics公司利用其新型扩散衣壳AAV.SPR开发的基因疗法,用于治疗X连锁视网膜劈裂症(XLRS)。XLRS是由RS1基因的突变引起的,该基因编码一种名为retinoschisin的蛋白,这是一种主要由光感受器分泌的蛋白质,位于视杆细胞、视锥细胞和双极细胞的外表面。XLRS的特点是视网膜层的异常分裂,这会导致视力受损,且无法通过眼镜矫正,随后会导致进行性的视力丧失。该病目前尚无批准的治疗方法。
ATSN-201使用的病毒衣壳能够横向扩散到视网膜下注射点以外的位置,实现对中央视网膜的安全和有效的基因递送(在XLRS患者的视网膜中,分裂腔主要集中在中央视网膜部位)。此前的研究显示,AAV.SPR在临床剂量下能够有效递送载荷至视网膜中央凹上的视锥细胞,无需手术分离,并且不会引起炎症。
此次公布的数据显示,ATSN-201在1/2期临床试验首个队列的所有3名患者中耐受性良好,没有报告严重不良事件。数据和安全监测委员会建议继续进行第二组,以测试下一个剂量水平的ATSN-201。
RGLS8429:公布1b期临床试验数据
Regulus Therapeutics公司公布了其开发的新型下一代寡核苷酸疗法RGLS8429用于治疗常染色体显性多囊肾病(ADPKD)的1b期临床试验的新数据。常染色体显性多囊肾病是由PKD1或PKD2基因突变引起的,也是最常见的人类单基因疾病之一,同时是终末期肾病的主要原因。RGLS8429旨在抑制miR-17并优先靶向肾脏,在临床前研究中已被证明能够明显改善肾脏功能、大小和其他疾病严重程度指标,并具有优越的药理学特征。此前,该公司已公布1期单次递增剂量临床试验的结果,结果显示,RGLS8429具有良好的安全性、耐受性和PK特征。
此次公布的是1b期研究中第二个队列的结果,患者对RGLS8429的耐受性良好,未发现令人担忧的安全性问题。基于尿液生物标志物分析结果,在2 mg/kg剂量水平下观察到RGLS8429的生物活性。基于影像学的生物标志物的探索性结果令人鼓舞,在PC1和PC2增加最多的患者中,总肾脏体积减少的幅度最大。PC1和PC2是PKD1和PKD2基因的蛋白质产物,已被证明与疾病严重程度呈负相关。
Sabirnetug(ACU193):公布1期临床试验的新数据
Acumen Pharmaceuticals公司公布了其新药sabirnetug用于治疗阿尔茨海默病(AD)的1期临床试验的新数据。Sabirnetug是一种选择性靶向毒性可溶性β淀粉样蛋白寡聚体(AβOs)的选择性人源化单克隆抗体。Sabirnetug能够结合AβOs,由于其独特的结合特性,sabirnetug有可能在产生淀粉样蛋白相关成像异常(ARIA,一种抗体疗法产生的常见主要副作用)风险较低的情况下提供治疗益处,因为sabirnetug可以在不直接靶向淀粉样斑块的情况下阻断AβOs的毒性作用。
2023年7月公布的结果显示,该试验的初步结果达到了主要和次要目标,为sabirnetug的临床机制验证提供了证据。在较高剂量组的患者中观察到淀粉样斑块快速、剂量相关的显著减少(p=0.01),每四周给药一次60 mg/kg sabirnetug组患者的淀粉样斑块在第63天减少了25%,每两周给药一次25 mg/kg sabirnetug组患者的淀粉样斑块在第70天减少了20%。这一结果与已批准的Aß单克隆抗体在其临床开发阶段相似时间点的平均淀粉样蛋白斑块减少相当。
此次公布的脑脊液生物标志物结果显示,与接受安慰剂治疗的患者相比,接受sabirnetug治疗的早期AD患者大脑中与AD病理学相关的生物标志物得到了改善,神经粒蛋白(neurogranin)水平降低了13.9%,p-tau181水平降低了13.0%,Aβ42/40比率呈上升趋势。在所有剂量中,AβOs的靶点作用与神经粒蛋白以及p-tau181的变化之间均存在显著的相关性,高度支持sabirnetug在早期AD患者大脑中的下游药理作用。该公司计划在2024年上半年启动sabirnetug的2期临床试验。
ATR-258 Atrogi:公布1a/b期临床试验数据
Atrogi公司宣布,其新型β2肾上腺素受体(β2-AR)激动剂ATR-258治疗2型糖尿病(T2D)患者的1a/b期临床试验达到了所有终点。ATR-258可与β2-AR结合,启动葡萄糖向骨骼肌运输的过程,从而降低血糖水平,并对受T2D影响的多个器官产生积极影响。这种专有的小分子化合物以一种新颖的方式激活受体,导致选择性调节和独特的信号传导特征。这种创新方法使解决2型糖尿病的核心问题成为可能。临床前研究表明,它能有效地将2型糖尿病状态逆转到健康水平。
KIO-101:公布1期临床试验数据
KIO-101是Kiora Pharmaceuticals公司的一种靶向二氢乳清酸脱氢酶(DHODH)的下一代非甾体类免疫调节小分子抑制剂,旨在克服市售的DHODH抑制剂的相关脱靶副作用和安全问题。
此次公布的结果显示,使用12天KIO-101滴眼液在24名健康受试者中的安全性和耐受性良好,没有观察到严重的不良事件。与安慰剂组相比,治疗组的结膜充血明显减少。结膜充血是眼部炎症的体征,由多种非感染性和感染性原因引起。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..