识林最近汇总了2013-2023财年FDA 483 年度审计缺陷列表,并发布了对2023财年483缺陷项的统计梳理。值得注意的是,在“实验室控制”一类中,有一条关于稳定性研究的缺陷项,是首次出现的全新表述。该缺陷项描述为:顺势疗法药品的稳定性评估并非基于药品上市时的同一容器密闭系统(21 CFR 211.166(c)(2))。可见FDA对稳定性研究的重视程度。本文将对稳定性研究相关缺陷、检查关注点和案例做简要梳理。
稳定性相关缺陷和频率
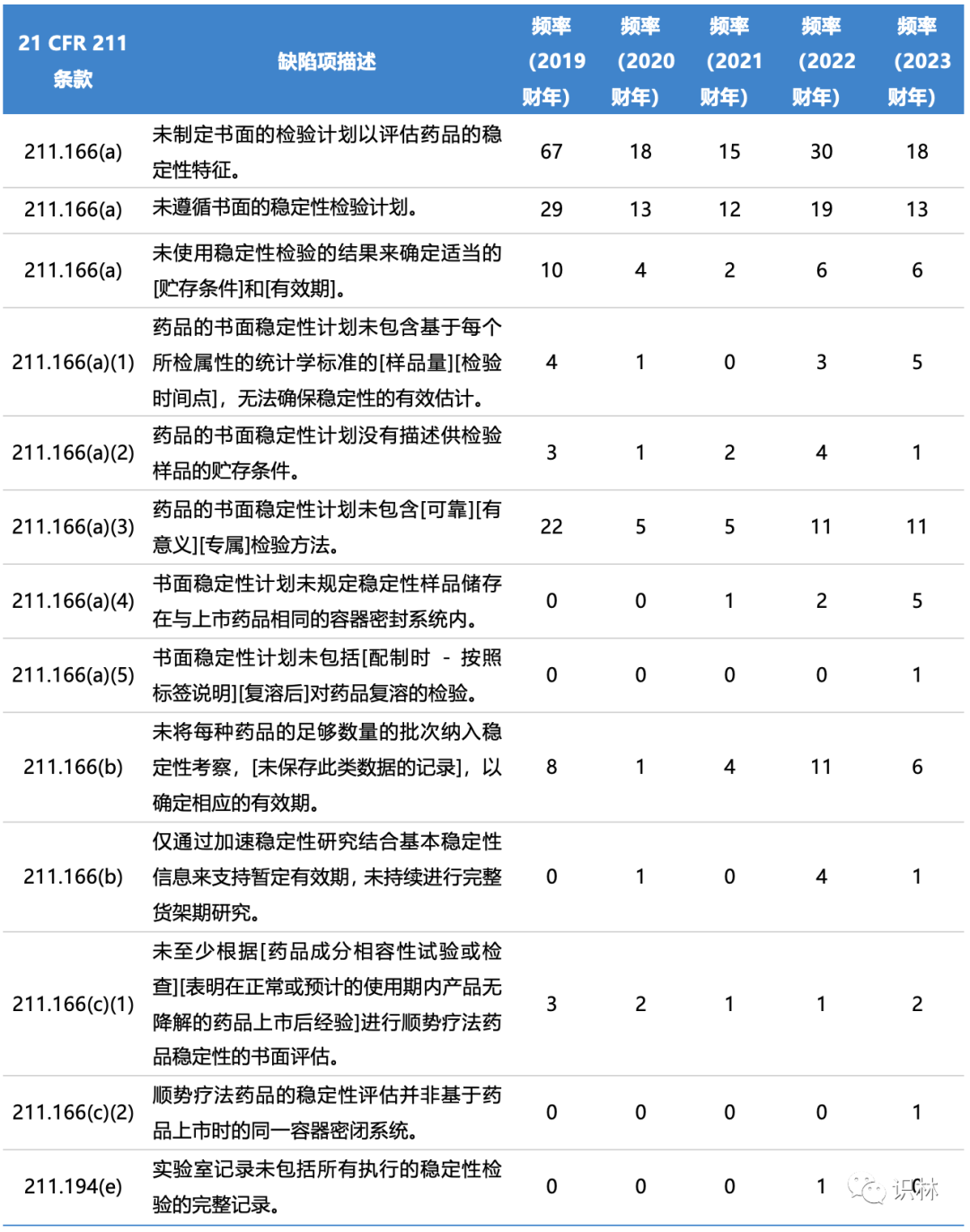
药物稳定性研究是一门成熟的学科,当然也是一项重要的监管要求,近年来许多FDA 483中提到了稳定性计划的缺陷。表1概述了近年来与稳定性相关的典型缺陷和出现频率。
表1. FDA近年来483表涉及稳定性的缺陷项和出现频率
中美检查文件中对稳定性的关注点
除法规要求外,中美监管机构/组织也制定了相应的检查工作程序或合规手册,明确了稳定性的检查范围、要求及风险的判定原则,并列举了稳定性相关的检查缺陷,见表2。
表2. 中美现场检查程序文件中稳定性相关要求和缺陷

稳定性相关FDA警告信案例
20210127 Allay Pharmaceuticals, LLC 美国 FDF
3. 企业未能建立并遵守旨在评估药品稳定性特征的充分的书面检验程序,并使用稳定性试验结果判定适当的贮存条件和有效期(21 CFR 211.166(a))。
企业的稳定性计划是不充分的。企业使用新供应商的API生产的商业规模验证批没有充分的长期稳定性数据支持。此外,企业未能通过始终如一地执行崩解检验来遵守稳定性检验方案。使用新API供应商的验证批次是在2019年5月16日至6月25日生产的,但直到2020年5月1日(差不多一年后)才被纳入长期稳定性研究。
稳定性数据对于确保产品在其货架期内保持鉴别、规格、质量、纯度和安全性至关重要。
在回复中,企业表示已启动了针对稳定性检验缺失的偏差调查,并且这些缺陷不会再次发生。还将聘请稳定性协调员来监督稳定性计划。
企业的回复不充分,因为没有提供临时措施来解决在售产品缺乏长期稳定性数据的问题。
在对此函的回复中,请提供以下内容:
一份综合独立评估以及CAPA计划,以确保稳定性计划的充分性。整改后的计划应包括但不限于:
具有稳定指示性的方法;
每种药品允许分销前在其容器密封系统中的稳定性研究;
持续计划,每年增加每个产品的代表性批次以确定货架期声明是否仍然有效;
每个点(时间点)要检测的具体属性的详细定义;
描述整改后的稳定性计划的以上要素和其他要素的所有规程。
作者:识林-雪杉
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..