美国FDA在癌症治疗药物的开发过程中,对总生存期(OS)数据的要求正日益严格,特别是对于新兴的肿瘤治疗药物而言。多年来,FDA一直接受无进展生存期(PFS)作为加速批准新抗癌药物的一个关键终点和替代性指标。然而,随着药物种类的增加和治疗方法的创新,FDA现在更加倾向于要求医药公司提供充分证据,以证实其疗法能够实质性地延长患者的生存期。对此,诺华公司(Novartis)首席执行官Vas Narasimhan博士在公司季度财报电话会议上提出了在PFS数据之外,追求更多OS数据的重要性。本文将分析这一策略转变的背后原因,它可能对癌症药物的开发和审批程序带来的影响,以及这一变化对患者及医疗服务提供者可能意味着什么。
总生存期数据对于评估癌症治疗的临床效果至关重要,因为它直接反映了患者接受治疗后的生存时间。与仅测量从治疗开始到疾病进展或死亡所经历的时间的PFS不同,OS数据反映了癌症治疗最根本的目标——延长患者的生命。这在晚期或转移性癌症患者中尤为关键,对于这一群体,疾病的进展通常难以避免,治疗的焦点在于最大限度地延长生存期并保持或提高生活质量。FDA强调更可靠OS数据的要求,显示了其致力于确保新的抗癌药物不仅要有延缓疾病进展的效果,同时也要在提高患者整体生存期和生活质量方面有所作为。
为什么FDA加大对OS数据的审查力度?
多年来,PFS一直被广泛用作癌症药物审批的替代终点,并且在临床试验中常被用作OS的替代指标。使用PFS作为替代终点有几个优点,它使得临床试验能在更短的时间内进行,只需较小的样本量,同时它还能比等待OS数据揭示更快地证实治疗带来的临床效益。此外,PFS也被认为是一个有临床意义的终点,因为它反映了患者在接受治疗后疾病进展的延迟情况。
虽然无进展生存期常用作评估癌症治疗药物的替代终点,但它在预测总生存期方面存在局限性,尤其是当患者发生疾病进展接受后续治疗时,PFS与OS之间的相关性可能变得不明确。其次,PFS未必能全面体现治疗带来的所有临床效益,特别是当治疗不能明显改善患者的总生存期或生活质量时。例如,一种虽然能延缓疾病进展,但因副作用大或无法显著提升总生存期的治疗,可能不会被视为临床上有意义的进步。此外,过分依赖PFS作为审批依据可能会使一些未能显著改善患者预后的治疗方法获批,特别是当OS数据未能得到及时收集和分析时。因此,FDA正日益要求在癌症药物研发中,尤其是对于那些PFS与OS关系可能不太明确的新药类别,提供更为可靠的OS数据,确保新治疗方法不仅能延缓疾病进展,更重要的是能够实质性地改善患者的生存期和生活质量。
FDA对缓解率、疾病进展和生存期之间关系的理解正在不断深化,FDA肿瘤卓越中心主任Richard Pazdur博士在7月份举行的FDA-AACR行业联合研讨会上解释说,PFS终点的长期使用是在细胞毒性化疗成为常规疗法的情况下产生的,在此情形下,缓解率、疾病进展和生存期之间存在很强的相关性。然而,当使用新型药物进行治疗时,这种情况可能并不总是正确的。
例如,在一项针对转移性去势抵抗性前列腺癌的临床试验中,诺华公司开发的放射性药物Pluvicto在延迟疾病进展方面显示出了效力,相较于激素疗法,其中位影像学无进展生存期(rPFS)延长了约六个月。然而,其对OS的影响仍然不明确。这部分是因为在临床试验的对照组中,有相当数量的患者在经历了病情恶化后转而接受Pluvicto治疗,这影响了总生存期数据的清晰度。因此,尽管在阻止疾病进展方面有积极结果,Pluvicto是否能迅速获得批准还存在不确定性。这一情况凸显了以PFS为替代终点所具有的局限,以及在评价抗癌药物是否真正改善患者预后时,需要更确凿的总生存期数据的重要性。
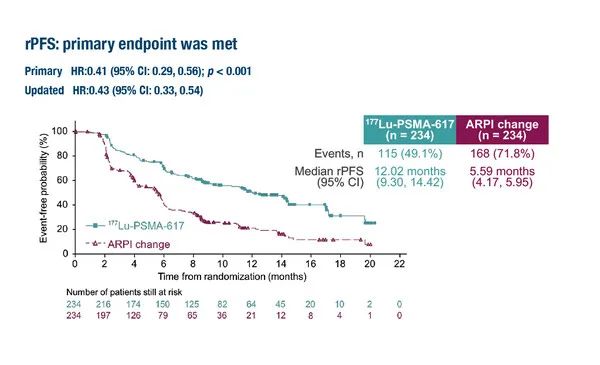
▲Pluvicto治疗显著延长了转移性去势抵抗性前列腺癌的影像学无进展生存期(图片来源:参考资料[2])
Pazdur博士进一步指出,尽管有些新批准的药物在PFS或缓解率上的改善微乎其微,但在分析OS数据时,这些药物显示出了积极的影响。这表明在评估新癌症治疗药物的效益时,除了考虑对PFS的影响,总生存期的数据也是至关重要的。通过要求提供更多临床获益证据,FDA希望确保抗癌药物能够真正改善患者的预后,而不仅仅是延缓疾病进展。
2018年发表在《美国医学会杂志》(JAMA)子刊JAMA Network Open上的一篇论文得出结论认为,“PFS不能充分体现PD-1抑制剂的益处”,这意味着总生存期仍应是PD-1抑制剂试验的金标准终点。
该研究对成年实体瘤患者中使用PD-1抑制剂(主要为纳武利尤单抗和帕博利珠单抗)进行治疗的随机对照试验进行了相关性和Meta分析,并评估了基于PFS和OS的临床结局相关性以及治疗效应量差异。分析结果发现,OS和PFS在中位数和中位数增益方面没有显著相关性,但它们的风险比显著相关。PD-1抑制剂治疗对总体生存率的改善作用大于无进展生存率。

▲初步分析显示,OS的治疗效应量大于PFS(图片来源:参考资料[3])
此外,根据HHS旗下的医疗保健研究和质量管理局出版的一本书,2005年到2010年间监管机构批准的以PFS为主要终点的晚期实体上皮癌药物并不一定显示出OS的增加。
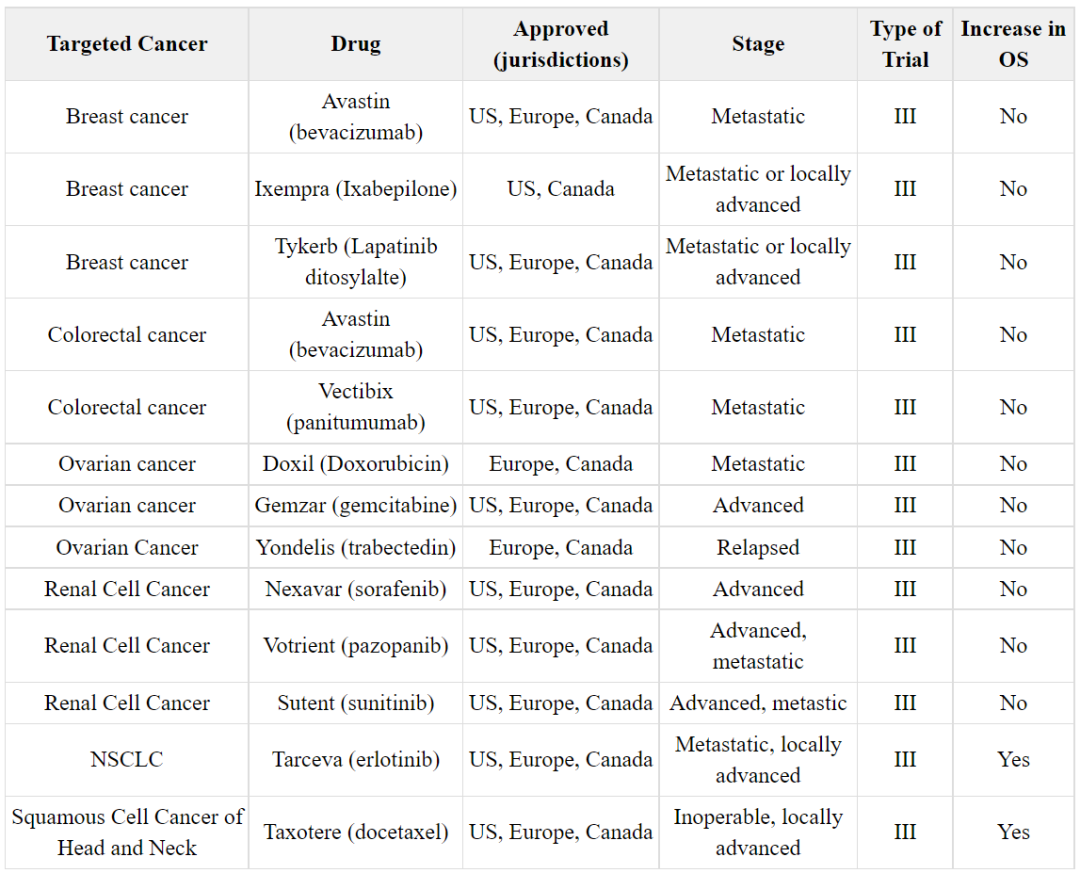
▲2005年至2010年间监管机构批准的以PFS为主要终点的晚期实体上皮癌治疗药物(图片来源:参考资料[4])
美国FDA在癌症药物的开发和批准过程中,对OS数据的要求不断提高,这一政策的影响是深远的。这种潜在监管的改变预计将对癌症药物的开发流程产生显著的影响,因为它将迫使药物研发公司收集和分析更加全面的患者结局数据,这不仅包括总生存期,还包括生活质量相关指标。这一需求可能会延长药物开发的时间线,提高成本,并增加临床试验的复杂性。然而,这样的转变也可能对患者产生更加深刻的临床益处,因为治疗的评价将基于其提升整体生存期和生活质量的能力,而非单纯延缓疾病进展的效果。
对于药物研发机构在适应对OS数据要求所面临的新挑战,有几个因素需予以考虑。首先,相比PFS数据的收集,收集和分析OS数据往往更为复杂和耗时,需要较长的随访时间和更大的样本量。其次,当一个治疗方案在OS上明显胜过另一个方案时,使用OS作为终点可能涉及伦理上的考量。在某些情况下,证明继续一个在OS上明显逊色的试验的合理性也可能颇具挑战。此外,定义和测量OS时也可能遇到难题,尤其是在患者可能接受多条治疗线或存在其他可能影响生存结果的混杂因素,例如合并症或其他健康问题。最后,解读OS数据也可能面临一些挑战,尤其是在不同试验中患者群体或治疗方案存在差异的情况下。尽管面临这些挑战,但药物开发商逐渐认识到,为了证明其治疗方案的临床益处并满足监管机构不断升级的标准,收集可靠的OS数据的重要性正日益加强。
结语
总之,FDA对更可靠OS数据的重视标志着癌症药物开发格局的关键转变。这一举措不仅是对更严格的临床益处证据标准的追求,也反映了对以患者为中心护理的日益增长的承诺,特别是将对患者生存时间和生活质量的实际影响置于优先地位。虽然对OS数据需求增加给药物开发人员带来了一系列挑战,包括更长的试验持续时间和潜在的成本增加,但这一切都旨在确保上市的药物能够为患者带来实质性的生命延续益处。FDA在此过程中的作用不仅体现了其在新疗法评价标准上的革新,而且还在推动肿瘤学研究和开发朝向更具意义的患者结果方向发展。随着行业对这些严格标准的适应,其所承诺的不仅是更为有效的癌症治疗方案,而是一种新模式——在这一模式下,治疗的价值将通过其对患者在面对疾病挑战时生活质量的实际改善来衡量。
参考资料:
[1] FDA pushes cancer drug developers to include overall survival data more frequently,Retrieved November 2, 2023, from https://endpts.com/fda-pushes-cancer-drug-developers-to-include-overall-survival-data-more-frequently/
[2] 177Lu-PSMA-617 improves rPFS in taxane-naïve metastatic castration-resistant prostate cancer,Retrieved November 2, 2023, from https://dailyreporter.esmo.org/esmo-congress-2023/genitourinary-cancers/177lu-psma-617-improves-rpfs-in-taxane-naive-metastatic-castration-resistant-prostate-cancer
[3] Gyawali B, Hey SP, Kesselheim AS. A Comparison of Response Patterns for Progression-Free Survival and Overall Survival Following Treatment for Cancer With PD-1 Inhibitors: A Meta-analysis of Correlation and Differences in Effect Sizes. JAMA Netw Open. 2018;1(2):e180416. Published 2018 Jun 1. doi:10.1001/jamanetworkopen.2018.0416
[4] Gutman SI, Piper M, Grant MD, et al.Rockville (MD): Agency for Healthcare Research and Quality (US); 2013 Apr.
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..