10 月 28 日,君实生物海外合作方 Coherus Biosciences 宣布,PD-1 单抗特瑞普利单抗 LOQTORZI™ (toripalimab-tpzi) 已获 FDA 批准,治疗 2 项鼻咽癌(NPC)适应症:
1)联用顺铂/吉西他滨一线治疗晚期复发或转移性 NPC;
2)作为单药疗法,用于铂类化疗后进展的不可切除或转移性 NPC
这是国产 PD-1 在美国斩获的首个上市批准,具有里程碑意义;值得一提的是,特瑞普利单抗也曾是国内首个批准上市的国产 PD-1。
在此次获批之前,美国地区尚无其他 PD-1 单抗获批鼻咽癌适应症。
Coherus 官方发布

截图来自:Coherus 官网
君实在美国的上市申报颇为曲折。特瑞普利单抗是最早向 FDA 递交 BLA 申请的国产 PD-1 之一,还获得了优先审评资格,不过由于质控流程变更和现场核查受阻,曾收到 FDA 发出的 CRL,后又再次向 FDA 申报上市,审评过程中又延期了一次。
如今经过从 2021 年起历时超过两年的审评和沟通,君实与 Coherus 终于斩获了这项关键的海外市场批准,即将开始新的篇章。
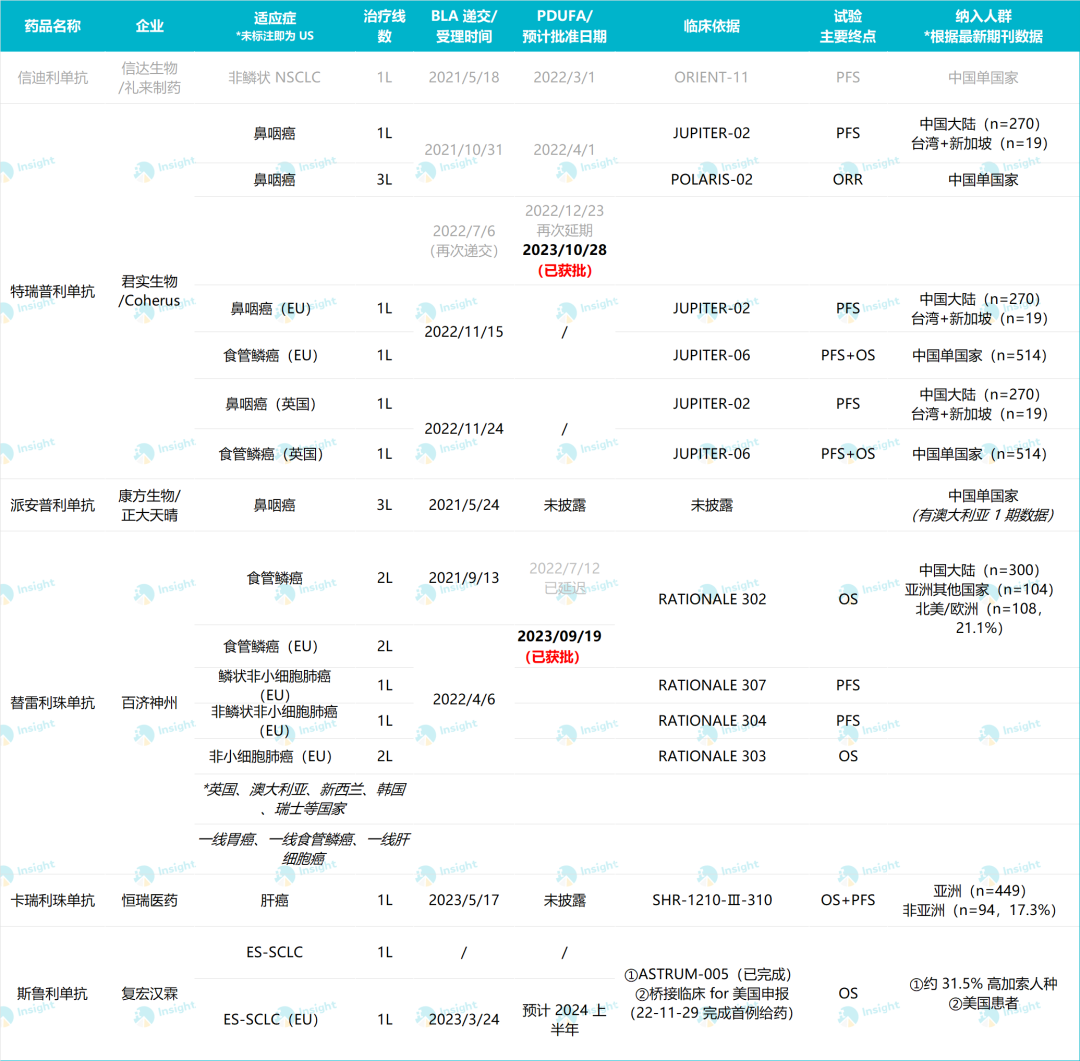
特瑞普利单抗的 BLA 是基于 JUPITER-02(一项随机、双盲、安慰剂对照、国际多中心 III 期临床研究)及 POLARIS-02(一项多中心、开放标签、II 期关键注册临床研究)的研究结果。
JUPITER-02 研究(NCT03581786)由中山大学肿瘤防治中心主任、院长徐瑞华教授牵头,研究成果在 ASCO 2021 上以全体大会「重磅研究摘要」(LBA)形式发表,亦于 2021 年 8 月获 Nature Medicine(IF=53.440)在线发表。
JUPITER-02 研究属于国际多中心 III 期临床,纳入患者均为亚洲患者,探索特瑞普利单抗联用化疗作为 NPC 一线疗法,试验终点为 PFS。根据 Nature Medicine 文章报道,2018 年 11 月 10 日至 2019 年 10 月 20 日,共纳入 289 名患者,其中中国大陆 270 例,台湾和新加坡共 19 例。
结果显示:
特瑞普利单抗+化疗 vs 化疗: BIRC mPFS (21.4 月 vs 8.2 月),相较于对照组,显著延长 13.2 个月,提升了近 3 倍,疾病进展或死亡风险降低 48%
OS(NE, 33.7),3 年 OS 率 64.5% vs 49.2% ,HR=0.63 (95% CI: 0.45-0.89) P=0.0083 ,较对照组提升了 15.3%,死亡风险降低 37%,具有显著的统计学差异
ORR:78.8% vs 67.1%,P=0.0221,具有统计学差异。
疾病缓解时间(DoR)长达 18 个月,相较于化疗组的 6 个月,提升了整整 12个月
POLARIS-02 结果显示,
单药治疗总体 ORR 达 20.5%,达到研究主要终点;
中位总生存 OS 高达 17.4 月;
一旦起效,持久缓解:患者中位 DOR 达 12.8 月
回顾来看,据 Insight 数据库显示,君实生物在美国地区的布局最早始于 2018 年 2 月 5 日。当时特瑞普利单抗在 ClinicalTrials.gov 登记了一项 I 期临床,用于食管癌、鼻咽癌、肝细胞癌、胃癌等多种实体瘤(登记号:NCT03474640),招募了 198 例患者。
迄今,君实的申报适应症已经不限于鼻咽癌,而拓展到了食管癌领域。申报地点也不仅限于美国,而向欧盟和英国开启了征程。在国内,今年也积极申报了包括 NSCLC 围手术期治疗、TNBC 一线治疗、RCC 一线治疗、ES-SCLC 一线治疗 4 项适应症。
随着百济神州 PD-1 在欧洲获批上市、君实 PD-1 在美国获批上市……今年真正成为了国产 PD-1 们的「出海元年」。
附表:国产 PD-1 出海进程(表格为人工根据官方发布信息整理,如有遗漏还请评论区指正)
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..