2023年1月30日,美国FDA处方药使用者付费法案(PDUFA)和生物类似药使用者付费法案(BsUFA)更新了对“面对面正式会议”的定义,将线上会议正式纳入面对面正式会议(FTF会议)的范畴。此前由于疫情原因,企业与FDA的沟通只能通过视频和电话会议,随着新冠疫情接近尾声,药品审评与研究中心(CDER)和生物制品审评与研究中心(CBER)将从2月13日开始,重新启动线下的FTF会议。
为避免会议室过度拥挤, FDA建议企业采用“混合模式”,即只有核心参与者线下出席进行发言,其他人线上参与。为支持此类会议,FDA将分阶段逐步对办公室进行升级改造,为其配备降噪技术、麦克风、摄像机等设备。随着2023年会议室的升级和工作人员的过渡,可通过“混合模式”举行的会议数量将有所增加。关于FTF正式会议过渡的最新信息FDA都将通过网站提前传达。
初期由于可用的混合型会议室的数量限制,线下FTF会议将先从A型(针对临床暂停或重要安全问题的创新药物)、BPD1类会议(针对临床暂停或重要安全问题的生物类似药物)和X型会议(针对非处方药专论药物开发相关的重要安全性问题)开始,其他类型的会议目前仍仅限线上接入。公平起见,FDA在 2023 年2 月 13 日之前收到或已经安排的会议将仍然采用线上方式进行。
关于申请人在药品开发过程中可以申请的会议类型,中美略有不同,下面分别来看看。
FDA的正式会议类型
根据PUDUFA Ⅶ,申办者与FDA之间可发起的正式会议类型有:Type A, Type B, Type B (end of phase (EOP)) , Type C, Type D和INTERACT会议。
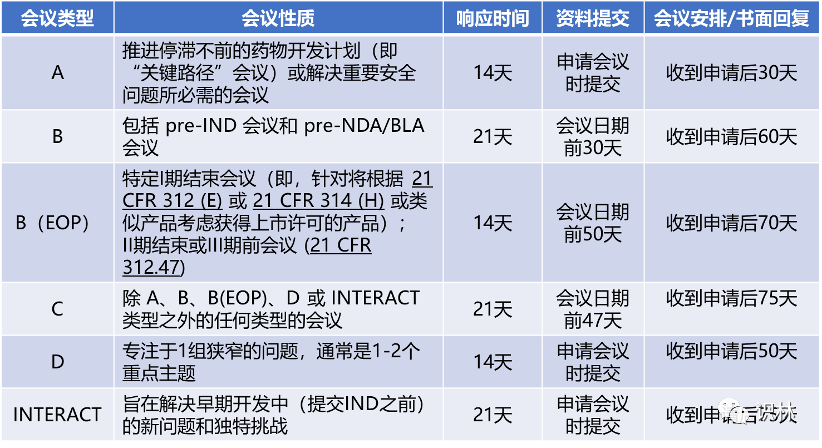
注:响应时间为FDA收到会议请求起的日历天数
针对生物类似药开发,FDA也建立了生物类似药开发计划(Biological Product Development, BPD)。指南《FDA 与 BsUFA 申请人或申办人之间的正式会议》中明确申办者可以请求的正式会议类型有5种:初次咨询会议(BIA)、第1类会议(BPD1)、第2类会议(BPD2)、第3类会议(BPD3)、第4类会议(BPD4)。正式会议有三种形式:面对面会议,电话会议/视频会议和仅书面回复(WRO)。
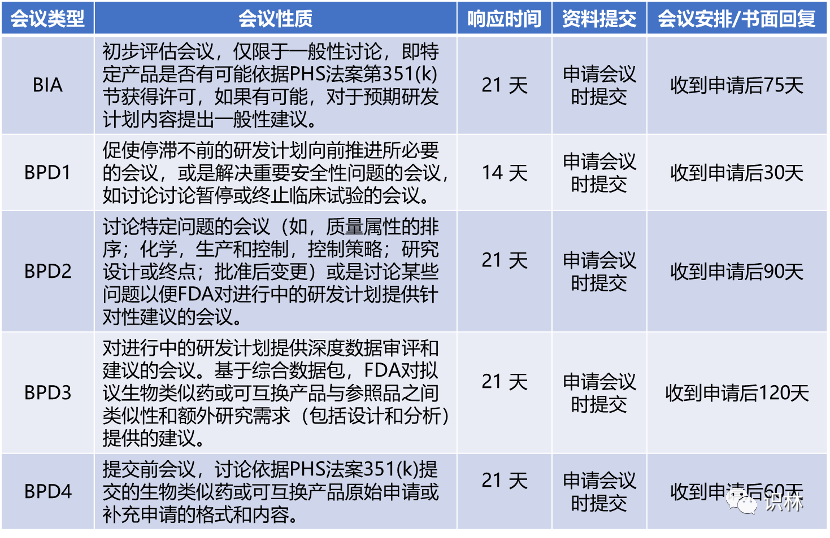
注:响应时间为FDA收到会议请求和会议资料起的日历天数
NMPA的沟通交流会议
为加强对药物研发与技术审评沟通交流工作的管理,CDE制定了《药物研发与技术审评沟通交流管理办法》,就药物开发的关键阶段重大问题进行沟通交流,会议类型有:Ⅰ类、Ⅱ类和Ⅲ类。

会议形式包括面对面会议,视频会议,电话会议和书面回复。
提交会议申请时,申请人需提供3个会议日期的备选时间,还需应指定1-2名药品注册专员以便后续联络。
会议资料需包含讨论问题清单以及支持性数据总结,由申请人按照《沟通交流会议资料》(附件2)要求通过“申请人之窗”提交电子版会议资料。
一般情况下,沟通交流会议时间为60-90分钟内。
会后申请人需按照《沟通交流会议纪要模板》(附件3)要求撰写会议纪要,对双方达成一致的,写明共同观点;双方未达成一致的,分别写明各自观点。最迟于会议结束后30日内定稿。
结语
两相比较,国内的Ⅰ类、Ⅱ类、Ⅲ类沟通交流会议,基本与PDUFA正式会议类型中的Type A, Type B和 Type C相对应,对于Type D、INTERACT会议和生物类似药的会议,CDE并无更细致的划分和规定。
作者:识林-白蜡
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..