摘要:
间充质干细胞(MSCs)疗法因其在免疫调节和组织再生两方面独特的生物医学潜力,是公认的极有前景的免疫治疗替代方法。然而,尽管在多个研究领域的临床前研究已开展了多年,干细胞治疗的临床试验结果呈多样化甚至相互冲突。造成该差异的原因主要包括干细胞植入不良、生存率低、供体差异大等因素。目前,如何增强MSCs的一致性和有效性,克服MSCs的治疗障碍从而获得更好的治疗效果仍然充满挑战。本文提出了预处理、基因改造、生物支持材料应用以及联合用药等几大策略。在MSCs给药前,使用包括细胞因子、生长因子和天然免疫受体激动剂等生物活性物质,缺氧条件诱导甚至采用改进的培养方法,均为有效的MSCs疗效改善策略。与此同时,开展特异性针对某类疾病或某位患者的个性化治疗变得愈发重要。另一方面,将MSCs基因改造或生物相容性材料共培养的联合应用也有望成为更优的治疗策略。
正文:
MSC疗效增强策略
为提高MSCs治疗成功率,近年来人们主要采取了以下策略。首先选择合适来源的MSCs细胞;经细胞因子预处理或者改进的培养方式,通过旁分泌途径可增强MSCs的免疫抑制能力或改善细胞体内存活率;其次基因改造也不失为一个有力策略。最后,与免疫抑制剂或细胞支架等生物活性材料的联合应用,也能增强干细胞的体内生存与归巢能力。
MSC选择
在准备干细胞移植时,首先需要选择MSC。在临床前及临床研究初期需要评估输注的MSCs是否会引起受试者全身或局部的免疫反应。除了躲避受试者的免疫监测,MSCs供体的年龄也在评估范围。尽管似乎供体年龄对肌腱生发潜能影响不大,但来自高龄供体的MSCs在增殖、分化和免疫调节方面能力均落后。动物疾病模型中,输注年老的细胞治疗功能也会减弱。老年间充质干细胞的输注甚至会造成受试者严重的“炎症反应”而引起疾病恶化。衰老细胞所分泌的衰老相关的细胞因子(SASP),会加速周围细胞衰老、引起再生功能受损甚至免疫细胞募集。也可使用比其他成人干细胞更为原始的从新生围产组织中获得的MSCs,例如来源于脐带、脐血和华通氏胶来解决这一问题。
另一待解决的问题为不同背景下供体间的个体差异。某些特定疾病患者的MSC,其抗炎因子的分泌能力减弱,会削弱其治疗效果。因此,针对疾病的MSC特异性筛查很有必要。研究表明,有和无治疗效果的细胞克隆间表达谱存在显著差异。具有显著治疗效果的克隆高表达内皮素-1(EDN1),通过钙黏蛋白2(CDH2)和血管内皮生长因子(VEGF)显著提高了脐血间充质干细胞(UCB-MSCs)对心梗的治疗效果。UCB-MSCs具有供体依赖的个体差异,在心血管疾病领域,低氧预处理MSC可用于改善缺血性疾病,很有前景。大样本基因表达谱分析表明, UCB-MSCs在低氧预处理后高表达ANGPTL4, ADM, SLC2A3和CDON等基因且更有疗效,此类基因与的促血管生成特性相关,也可作为保证干细胞治疗效果的一般性指标。供体筛选的关键步骤包括对参考基因的验证。从IFN-γ预处理的AT-MSCs中提取的细胞外囊泡(EVs),几个miRNAs(miR-22-5p、miR-29a-5p、miR-26a-5p和miR-16-5p)可作为参考基因,用于骨关节炎的治疗。因此,在输注MSCs前,需建立相关疾病特异性筛查与选择标准。
MSC预处理
MSC具有可塑性,通过细胞因子/趋化因子、生长因子、受体激动剂、激素、药物和缺氧环境均可调节MSC功能,使其更适于目标适应症的治疗。
细胞因子和生长因子
移植的MSCs可以感知并响应微环境的局部炎症信号,称为“MSC许可”。大多数预处理方法为通过细胞因子/趋化因子或生长因子启动促炎过程。促炎因子、IFN-γ或TNF-α预处理是传统的提高MSC治疗效果的手段。IFN-γ刺激可增加包括PGE2、HGF、TGF-β和MCP-1在内的免疫调节因子的分泌。值得注意的是,IFN-γ-启动的MSCs通过抑制免疫效应细胞和促进免疫替代细胞的增殖,恢复免疫稳态。例如,IFN-γ预刺激使骨髓间充质干细胞(BM-MSCs)分泌更多PDL-1,从而抑制T细胞增殖和TH1细胞因子的分泌。IFN-γ-MSCs与淋巴细胞共培养期间,TH17细胞比例、IFN-γ和TNF-α的分泌均有所降低;IL-6和IL-10的分泌增加并促进Tregs的表达。
TNF-α作为另一个关键促炎因子,其免疫抑制作用弱于IFN-γ,也是通过刺激PGE2、IDO和HGF分泌起到免疫调节作用。据报道,TNF-α通过与其受体TNFR1和TNFR2结合,激活免疫细胞生存、增殖、侵袭和分化,NF-κB信号通路起到关键作用。TNF-α刺激的BM-MSCs上调COX-2以合成PGE2,增加巨噬细胞IL-10表达,减少IgE生成和组胺释放缓解过敏症状。
IL-1β-刺激通过上调TGF-β1和MMPs调节机体免疫平衡,促进MSCs迁移,促进伤口愈合,改善MSCs对目的适应症的治疗效果。
除IFN-γ、TNFα、IL-1β外,诸多细胞因子和生长因子均可用于MSC priming,汇总表格如下:
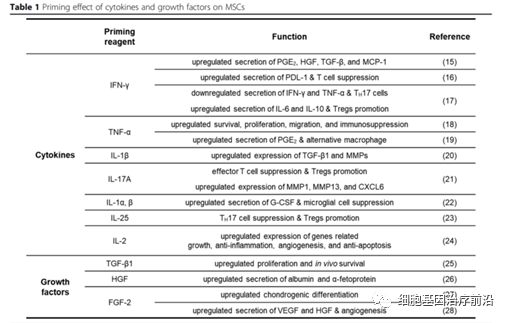
表1
免疫激动剂
与细胞因子和生长因子预处理MSCs类似,用天然免疫受体激动剂处理MSCs可作为非特异性启动策略。在MSCs中表达的Toll样受体(TLR)可以识别“危险”信号,TLR3和TLR4通过与其特异性激动剂多肽酸poly I:C和脂多糖LPS结合,调整MSCs的旁分泌模式,上调PGE2的分泌,激活Notch信号通路,促进Treg细胞亚群增殖,抑制TH1/17从而改善MSCs功能。经TLR3预处理的UC-MSCs在自身免疫病动物模型,尤其炎症性肠病中体现出更好的治疗效果。
尽管LPS激活TLR4会将MSCs强制转变为促炎表型,许多研究者仍证明TLR4的激活对可改善MSCs药效。LPS的功能刺激可持续数天,形成短期记忆。移植经LPS诱导的AT-MSCs可提高糖尿病动物模型中的皮瓣成活率。LPS还可刺激BM-MSCs的TLR4响应,诱导细胞激活因子BAFF增加。经TLR4处理的UC-MSCs所产生的外泌体,具有将单核细胞/巨噬细胞驯化为组织保护型的特性;这类经过“priming”的外泌体与单核细胞/巨噬细胞共培养所驯化的免疫细胞可用于治疗急性辐射综合征。
另外,TLR5能够上调IL-10、CCL24和TGF-β的表达,下调CCL5和IP-10。信息汇总如下:

表2
低氧诱导
低氧预处理也常用于MSCs的治疗改善。低氧诱导促进了趋化因子受体的表达,并且增强干性。HIF-1α可显著调节MSCs及其条件培养基的治疗效果。然而,低氧诱导的MSCs因其供体基因表达谱存在差异,治疗效果也有不同。不同报道称,模拟体内缺氧环境及血清剥夺将会改变BM-MSCs外泌体内的蛋白组成;低氧诱导的UC-MSCs所产生的外泌体通过上调miR-126促进软骨再生;低氧诱导的AT-MSCs及其外泌体VEGF表达水平显著提高,提示血管生成能力的增强。上调的VEGF分泌可恢复BM-MSCs对老年患者缺血性中风的神经保护作用。
培养方法改造
除了生物活性分子的预处理和低氧诱导,三维(3D)培养方法很大程度也可增强MSCs的治疗潜能。众所周知,细胞培养过程中的接触抑制会影响细胞状态甚至造成细胞死亡,MSCs的细胞间接触还会影响其分化潜能和免疫调节能力。3D培养系统可模拟干细胞在体内的物理状态,增加其产量和治疗效果。值得注意的是,最简单的3D培养方法是成球培养,可促进其抗炎和促血管生成特性。3D培养还可上调包括TGF-β1、PGE2和IL-6在内的免疫调节因子分泌,当与促炎细胞因子接触时,这种免疫调节作用将被增强。在生物物理支持材料中,水凝胶近年来备受关注。有人发现,含有透明质酸的水凝胶支持的3D培养可通过加速细胞周期同步,促进AT-MSCs逆转录病毒基因的高效转导。在水凝胶中的3D培养可改善软骨内固化,介导潜在的骨愈合特性。一项临床研究表明,培养在聚己内酯(PCL)上的WJ-MSCs能更有效缓解牙龈萎缩。最后,经UVB辐照预处理可能通过产生活性氧ROS改善AT-MSCs的生发作用。
MSC预处理的先进策略
免疫细胞与MSCs的相互作用,是间充质干细胞治疗的重要机制。某些特定疾病的风险因素,如免疫细胞过度激活,为开发特定疾病的干细胞治疗提供了重要线索。TH2细胞、B细胞和肥大细胞作为超敏及过敏反应的关键效应细胞,它们的激活在特异性皮炎的发病机制中十分重要。组胺激活BM-MSCs,上调IL-6的分泌水平。在体外经组胺预处理的肥大细胞刺激UCB-MSCs,通过免疫调节和刺激组织再生,可更有效地改善实验组特异性皮炎的症状。因此建议用效应细胞的分泌物质而非典型的促炎细胞因子(IFN-γ、TNF-α等)启动MSCs,可有效减少过敏反应和慢性炎症。这类方法也适用于其他疾病,通过分析疾病中的关键效应因子及发病机制,定制MSCs用于目标疾病的治疗。
MSC基因改造
对干细胞进行遗传修饰,可使其独立于外源刺激,提高其治疗潜力。多种基因的持续性增强表达均与提高MSCs的治疗效能有关。有报道称BM-MSCs过表达VEGF会促进血管生成并改善脑梗死,提高细胞活率并增强旁分泌效应。为实现低氧预处理效果,将HIF-1α转染至BM-MSCs可模拟其在低氧暴露下更强的治疗效果。过表达PGIS基因能增强干细胞对MI小鼠模型中受损心脏的保护,便于心脏功能恢复。另外,包括IL-4、IL-10、TGF-β1、GATA-4和CXCR4基因都有提高干细胞活率,增强疗效的作用。CRISPR/Cas9基因编辑技术也可广泛用于MSCs的基因改造。Keap1敲除能增强AT-MSCs的抗氧化效应,经CRISPR/Cas9编辑分泌sRAGE的UCB-MSCs将减轻神经元变性,显著改善帕金森小鼠的症状。
尽管基因编辑对MSC治疗具有稳定的改善效应,但这类操作不适用于实际临床应用,主要还是考虑到可能出现的安全问题。某种基因的持续特异性激活,可能是干细胞源恶性肿瘤发生的主要原因。因此,考虑通过瞬时基因修饰以改善治疗潜力也可作为努力方向之一。通过shRNA或通过试剂而非病毒基因递送系统进行基因调节,可能成为潜在的基因改造工具。
与支持性材料共培养
最近的研究重点已转移到开发共培养的辅料用于增强MSCs的治疗效应。与免疫抑制剂或是生物活性材料联用,可以绕开包括细胞启动或基因调控等额外准备步骤,因此更方便产品用于临床。共培养条件下,致瘤风险和异质细胞的污染风险均有所降低。如ECM和水凝胶等生物活性材料,还可用于3D培养构建组织和类器官结构。3D成球培养方法可鼓励细胞与细胞间联系,运用细胞支架可增加MSC归巢和谱系分化特性。运用诸如金纳米粒子和石墨烯等生物相容性先进材料开发产品临床前研究正在积极开展。
与药物联用
MSCs与包括雷帕霉素和他克莫司在内的免疫抑制剂联用,体现了药物的协同治疗效果,能显著改善MSCs移植存活率并减少药物不良反应。MIS416作为先天免疫刺激剂,能够改善UCB-MSCs的免疫调节能力,促进肠道免疫稳态,促进UCB-MSCs对结肠炎实验动物的治疗效果。有研究者证明,BM-MSC与A型肉毒素协同作用可在mRNA与蛋白水平下调肌动蛋白α-SMA的表达,用于治疗肥厚性瘢痕。与单一疗法相比,N-乙酰半胱氨酸(NAC)和MSCs联用对间质性膀胱炎实验模型的炎症抑制和凋亡缓解具有更好的效果。
未来展望
将前文提到的增强MSCs疗效的方法进行组合,可起到1+1>2的效果。例如将2D培养中的MSC-priming和3D培养方法相结合,能够进一步提高MSCs的疗效。将基因修饰后的增殖活性增强的MSCs放入生物相容性支架,再将该细胞—材料复合物与TNFα抑制剂共同植入受损关节,可用于退行性关节炎的治疗。基因治疗或免疫检查点相关的单克隆抗体也
可与MSC进行联用。将基因改造过表达HGF的BM-MSCs工程细胞接种于3D贴片移植入动物体内,其治疗效果优于天然MSCs。
需要关注的是,在干细胞治疗中,仍有诸多限制需要通过研究解决。建议开发“定制临床策略”,通过建立疾病微环境与移植细胞的特定联系,从而克服当前MSC治疗瓶颈。细胞输注的时间点也是需要考虑的重要因素。不同患者不同适应症的免疫状态存在差异,干细胞的反应性可能由炎性环境介导,因此可选择在炎症高峰期进行干细胞输注治疗,以达到治疗效果最大化。
原文:Lee and Kang Stem Cell Research & Therapy (2020) 11:397.Functional enhancement strategies for immunomodulation of mesenchymal stem cells and their therapeutic application.
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..