美国 FDA 于 2021 年 10 月 18 日最新发布了 2021 财年检查观察项汇总数据,本文重点查看药品制剂方面的 483 相关缺陷数据。
由于新冠疫情继续在世界绝大多数国家和地区肆虐,2021 财年 FDA 执行的检查数量仍然有限,而且执行的检查大多也是针对关键任务,涵盖面有限。所以 2021 财年的检查观察项对于广泛企业而言可能仍不具有代表性。
另外,提请大家注意,FDA 的数据仅包括通过其电子系统发布的 483 表格,不包括发送给原料药生产商的 483,因为 21 CFR 211 不适用于原料药商,也不包括电子系统之外手动发布的 483。因此,这些数据并不代表 FDA 对当年检查观察项的完整收集。过去几年中,这一数据大约代表了 FDA 发出的所有 483 的三分之一,因此本文的结论是根据相对不完整的数据得出来的。
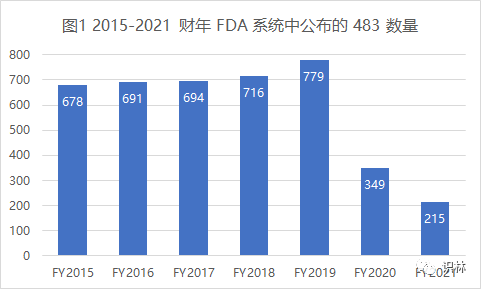
整体来说,2021 财年的检查行动仍严重受到疫情影响,体现在了 483 的发布数量上。2021 财年 FDA 共发布 215 封药品 483,比 2020 财年还少一百多封,更是不足疫情前正常水平的三分之一(见图1)。
2021 财年引证频率排在前 15 的 GMP 条款请见表 1。表中除显示了 2021 年排名前 15 的引证条款外 , 还给出了之前四年对应条款的引证数量。由于 2021 财年的特殊情况,从引证条款具体频率上不太具有可比性,但是从整体引证频率排名上还是可以看出一些趋势。
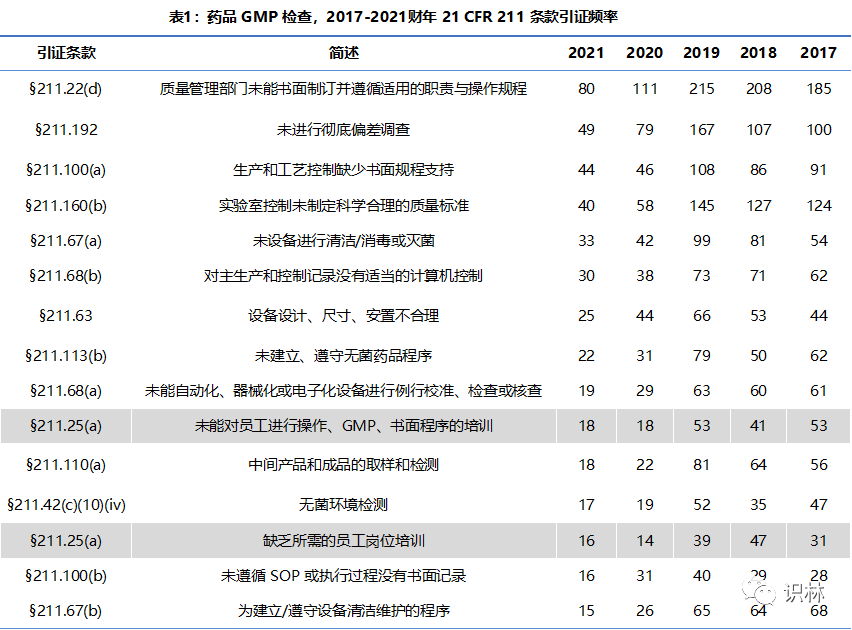
排名前四的引证条款过去五年来基本没有变化:
§211.22(d) 质量管理部门未能书面制订并遵循适用的职责与操作规程
§211.192 未进行彻底偏差调查
§211.160(b) 实验室控制未制定科学合理的质量标准
§211.100(a) 生产和工艺控制缺少书面规程支持
2021 财年与过去四年引证条款排名差异比较大的几条是:
1. §211.160(a) 未能同步跟踪/记录实验室控制 从去年排名前十五 , 下降到了 2021 财年的 30 名开外,不过这一缺陷项在 2019 财年及之前也都排名比较靠后;
2. §211.165(a) 未使用适当的实验室检测来确定产品是否符合质量标准 从前几年的前十五 , 下降到了 2021 财年的第十七位。
3. §211.25(a) 人员资质与培训 在去年短暂的调出前十五名外以后,今年又重新回到了榜单上。
作者:识林-蓝杉
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..