2月6日,药监局官网显示,艾力斯甲磺酸伏美替尼片新适应症获批上市,用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20 外显子插入突变的局部晚期或转移性NSCLC成人患者的治疗。
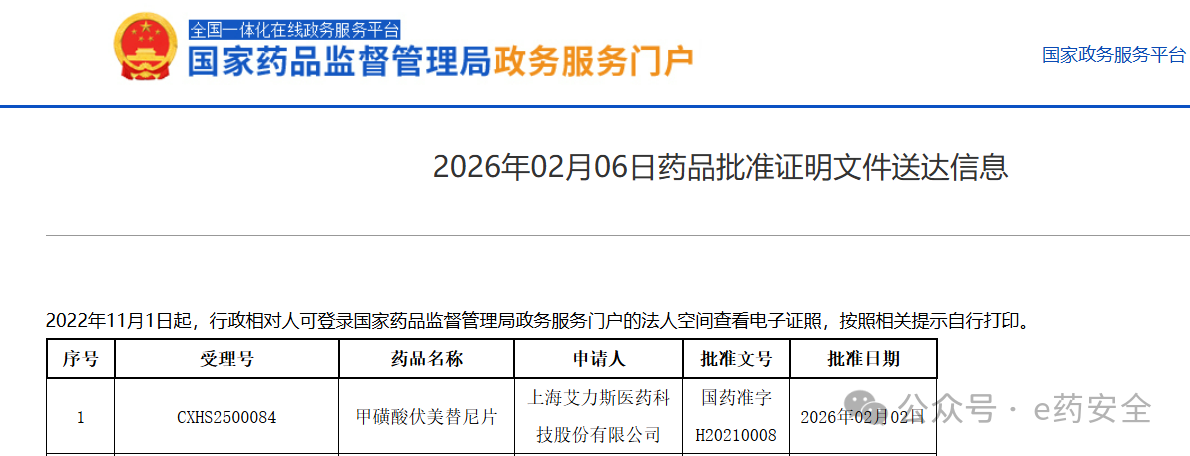
截图来源:药监局官网
伏美替尼是第三代 EGFR-TKI,此前已在国内获批 2 项适应症,分别为:1)用于治疗既往 EGFR TKI 治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性 NSCLC 成人患者;2)用于具有 EGFR 外显子19缺失(19DEL)或外显子21(L858R)置换突变的局部晚期或转移性 NSCLC 成人患者的一线治疗。
01
FURMO-003研究
此次获批是基于II期FURMO-003研究的临床试验结果。艾力斯在2025ESMO大会上公布了FURMO-003研究的详细数据。
FURMO-003研究:是一项II期、多中心、开放标签研究,旨在评估伏美替尼240mg用于既往接受过含铂化疗的EGFR Ex20ins突变局部晚期/转移性NSCLC患者的疗效和安全性。该研究共纳入71例EGFR Ex20ins突变患者,其中22.5%存在中枢神经系统(CNS)转移,所有患者均接受伏美替尼240mg QD治疗,直至疾病进展或不可耐受的毒性。主要终点为经盲法独立中心评估(BICR)确认的客观缓解率(cORR),次要终点包括缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)和安全性。
2025ESMO丨肺癌,靶向免疫治疗最新进展汇总
实时更新:2025ESMO肺癌重磅研究全解析(PPT+原始资料)
初步的 1b 期临床研究(FAVOUR)表明,Firmonertinib 在 240 mg/天的剂量下,对 Ex20Ins NSCLC 患者表现出显著且持久的抗肿瘤疗效,并且安全性良好。
关键入组标准
年龄 ≥ 18 岁;局部晚期或转移性 NSCLC;既往接受过铂类化疗;经确认的 Ex20Ins 插入突变;ECOG PS 0-1;允许无症状稳定的 CNS 转移
治疗方案
治疗: Firmonertinib 240mg,每日一次(QD),至疾病进展
肿瘤评估
疾病进展前:每 6 周(±3 天)一次
疾病进展后或开始新治疗后:每 12 周(±7 天)一次
研究终点
主要终点为 经独立评审委员会(IRC)根据 RECIST v1.1 标准确认的客观缓解率(ORR)
在伏美替尼240mg标准剂量治疗下,患者的最佳ORR为51.4%,cORR为44.3%,伏美替尼治疗的中位PFS达8.3个月,中位OS达21.2个月。
在近环、远环和螺旋状 Ex20Ins 突变中均观察到缓解。
中位最大肿瘤缩小率为 32.2%。
大多数缓解发生在Firmonertinib治疗的第一次肿瘤评估时。
中位首次缓解时间(TTR)为 1.4 个月(范围:1.2-5.6)。
最长的 DoR > 24 个月。
结论
在 FURMO-003 关键研究中,Firmonertinib 240mg QD 在既往接受过铂类化疗的 Ex20Ins NSCLC 患者中显示出显著的抗肿瘤活性。
——经 IRC 评估的确认客观缓解率(ORR)为 44.3%(240 mg 每日一次剂量下)。
——若排除 5 例 IRC 评估基线无可测量疾病的患者,确认的 ORR 为 47.0%。
——在近环、远环和螺旋状 Ex20Ins 突变中均观察到抗肿瘤活性,与插入位置无关。
——IRC 评估的中位无进展生存期(PFS)达到 8.3 个月,表明缓解持久且具有长期活性趋势。
——截至目前观察到的中位总生存期(OS)为 21.2 个月(OS 事件发生率为 32.9%)。
Firmonertinib 在 240 mg QD 剂量下表现出良好的耐受性。最常报告的治疗相关不良事件(TRAEs)主要包括胃肠道反应。未发现新的意外安全性信号。
Firmonertinib 可能成为既往接受过治疗的 Ex20Ins 突变 NSCLC 患者的潜在治疗选择。
一项评估 Firmonertinib 作为局部晚期或转移性 Ex20Ins 突变 NSCLC 患者一线治疗的全球注册 III 期研究正在进行中,并已完成入组(FURVENT/FURMO-004; NCT05607550)。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..