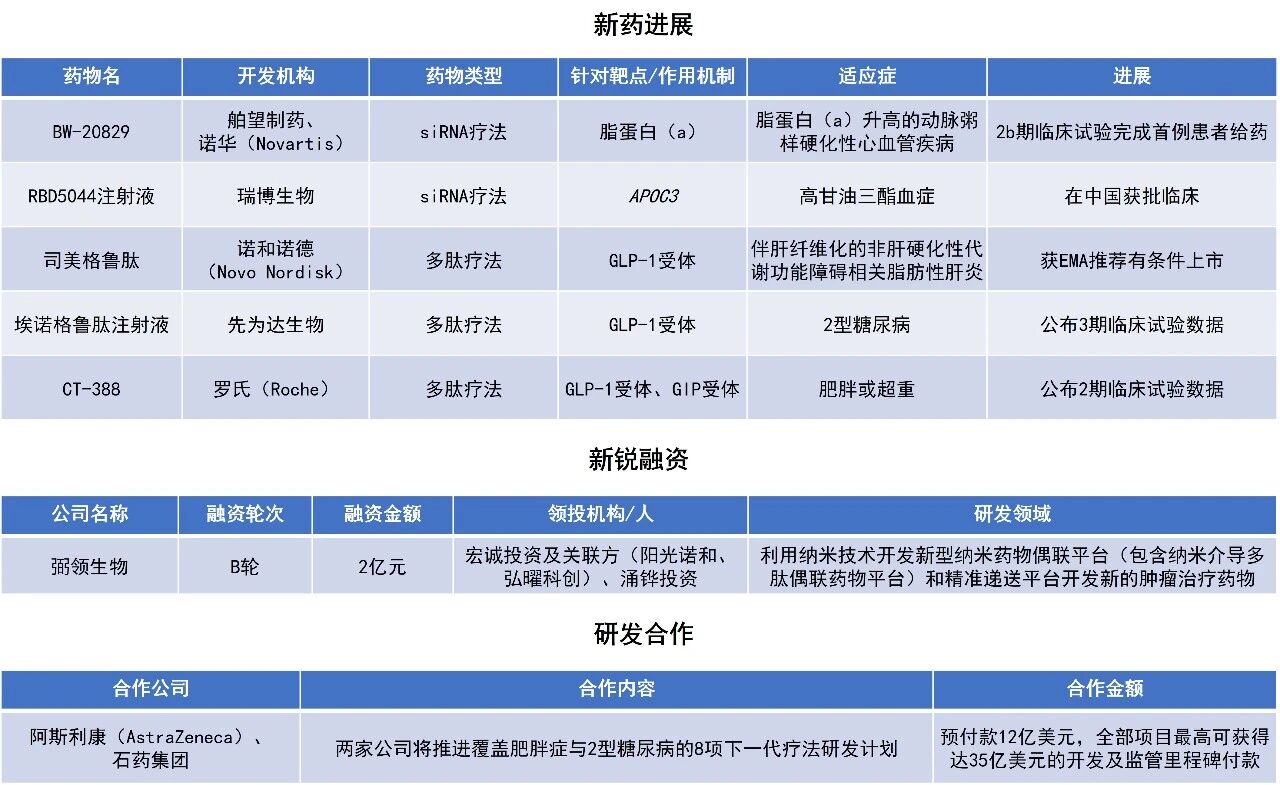
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。欧洲药品管理局(EMA)人用药品委员会(CHMP)建议有条件批准司美格鲁肽用于治疗伴有肝纤维化的非肝硬化性代谢功能障碍相关脂肪性肝炎(MASH)。先为达生物公布了埃诺格鲁肽注射液单药治疗2型糖尿病的积极3期临床研究结果,高剂量组患者中有80.3%的人实现了糖化血红蛋白(HbA1c)<7.0%的控糖目标。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
司美格鲁肽:获EMA推荐治疗MASH
EMA宣布,CHMP给出积极意见,建议授予诺和诺德(Novo Nordisk)旗下Kayshild(semaglutide,司美格鲁肽)有条件上市许可,用于治疗伴肝纤维化的非肝硬化性MASH。目前,欧盟已批准多款胰高血糖素样肽-1(GLP-1)受体激动剂用于治疗糖尿病和体重管理。根据新闻稿,Kayshild有望成为获EMA批准用于MASH适应症的首款GLP-1药物。
司美格鲁肽是一种GLP-1受体激动剂,它能够刺激胰岛素的生成,并抑制胰高血糖素分泌,降低食欲和食物摄入量。司美格鲁肽最初作为2型糖尿病的治疗药物获批上市(商品名:Ozempic),鉴于其在减重方面的显著效果,2021年6月FDA批准其用于治疗普通肥胖患者(商品名:Wegovy),它是自2014年以来美国FDA批准的首款用于控制普通肥胖症或超重的新药。2025年8月,美国FDA加速批准Wegovy用于联合低热量饮食和增加体力活动,治疗伴有中度至重度肝纤维化(2期或3期)的非肝硬化型MASH成人患者。
埃诺格鲁肽注射液:公布3期临床试验数据
先为达生物宣布,其研发的埃诺格鲁肽注射液单药治疗2型糖尿病的3期临床研究EECOH-1成果,成功登上学术期刊Nature Communications。埃诺格鲁肽注射液(ecnoglutide injection,曾用名:伊诺格鲁肽)是由先为达生物自主研发的cAMP偏向型GLP-1受体激动剂,依托创新的药物设计,其临床疗效及产能可扩展性得到显著提升。埃诺格鲁肽已成功完成三项3期临床试验,用于成人2型糖尿病患者血糖控制及成人超重/肥胖患者长期体重管理的两项适应症已在中国提交上市申请并获受理。
EECOH-1研究在饮食运动干预后血糖控制不佳的成人2型糖尿病患者中进行。研究结果表明,cAMP偏向型GLP-1受体激动剂埃诺格鲁肽注射液可以显著降低血糖,同时展示出降低体重、改善代谢指标等综合获益。具体而言,治疗24周后,埃诺格鲁肽注射液0.6 mg、1.2 mg组HbA1c降幅,均显著高于安慰剂组,其中1.2 mg组降幅达2.43个百分点。埃诺格鲁肽0.6 mg、1.2 mg组HbA1c<7.0个%、HbA1c≤6.5%的达标患者比例显著高于安慰剂组,其中1.2 mg组HbA1c<7.0%的达标比例高达80.3%。此外,该药的疗效可稳定持续至52周。安全性方面,埃诺格鲁肽注射液的整体安全性和耐受性良好。
CT-388:公布2期临床试验数据
罗氏(Roche)公布了临床2期试验CT388-103的积极顶线结果。该研究旨在评估其在研的每周一次皮下注射双重GLP-1/葡萄糖依赖性促胰岛素多肽(GIP)受体激动剂CT-388在肥胖患者中的疗效与安全性。CT-388拟用于治疗肥胖、2型糖尿病及其他与肥胖相关的合并症。该药物通过选择性靶向并激活GLP-1和GIP受体,整合营养信号以调控能量稳态,从而减少食欲并调节血糖。CT-388在设计上可强效激活GLP-1和GIP受体,但在两个受体上均几乎不招募β-arrestin。这种偏向性信号传导可显著减少受体内吞及随后的脱敏,预计将带来更持久的药理活性。
此次公布的结果显示,48周时,接受CT-388治疗的肥胖或超重患者,实现了22.5%的安慰剂校正体重下降,且未出现体重下降平台期。目前,CT-388还在另一项2期临床研究CT388-104中接受评估,以进一步考察其在肥胖或超重且合并2型糖尿病(T2D)受试者中的疗效和安全性。此外,CT-388用于治疗肥胖的3期临床试验项目(Enith1和Enith2)预计将于本季度启动。
阿斯利康与石药集团达成合作
阿斯利康(AstraZeneca)宣布与石药集团达成新的战略合作协议,旨在推进覆盖肥胖症与2型糖尿病的8项下一代疗法研发计划。根据协议,双方将率先推动其中4个项目,这些项目将结合石药集团先进的AI驱动肽类药物发现平台,以及其专有的LiquidGel每月一次给药平台技术。阿斯利康将获得石药集团每月一次注射型体重管理产品组合在中国以外地区的独家全球权益,该组合包括一款即将进入1期临床试验的长效GLP-1R/GIPR激动剂SYH2082,以及3项具有不同作用机制的临床前项目,旨在为肥胖及相关体重疾病人群带来更持久的治疗获益。
根据协议,阿斯利康将就8个项目及相关AI分子设计能力与LiquidGel平台技术,向石药集团支付12亿美元的预付款,并为全部项目提供最高可达35亿美元的开发及监管里程碑付款。此外,石药集团还将有资格获得后续商业化与销售里程碑等款项。石药集团将负责推动4个既定项目及新增4个项目直至完成1期临床;在1期试验成功完成后,阿斯利康将负责中国以外地区的进一步开发与商业化。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..