1 月 29 日,CDE 官网显示,康方生物依沃西(AK112)又一项申请拟纳入突破性疗法,适应症为依沃西联合吉西他滨和顺铂一线治疗晚期胆道癌。这是依沃西单抗第 5 次被 CDE 纳入突破性治疗品种。
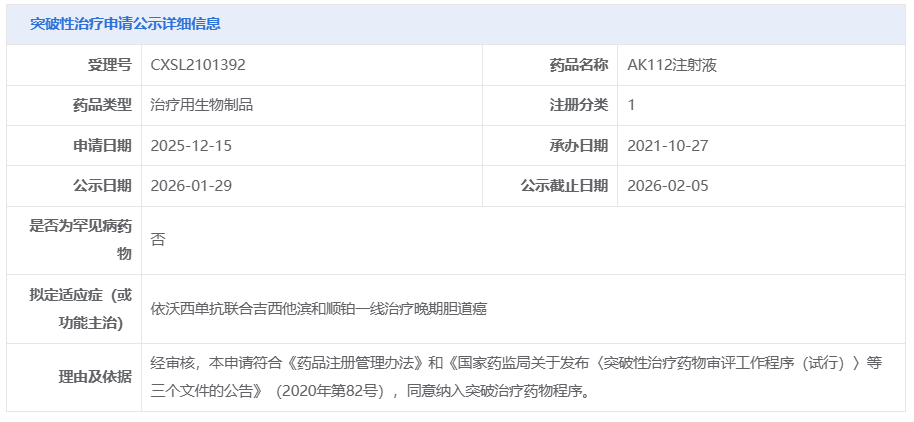
截图来源:CDE 官网
依沃西是康方生物自主研发的全球首创 PD-1/VEGF 双特异性肿瘤免疫治疗药物。该药于 2024 年 5 月首次获批,目前已在国内获批两项适应症,分别用于 EGFR-TKI 治疗进展的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)、一线治疗 PD-L1 表达阳性的晚期 NSCLC。
此前,依沃西已先后 4 次被 CDE 纳入突破性疗法,针对的适应症包括:1)联合化疗治疗 EGFR-TKI 治疗耐药的局部晚期或转移性 NSCLC;2)一线治疗 PD-L1 表达阳性的局部晚期或转移性 NSCLC;3)联合多西他赛治疗既往 PD-1/L1 抑制剂和含铂化疗治疗失败的局部晚期或转移性 NSCLC;4)联合化疗一线治疗局部晚期不可切除或转移性三阴性乳腺癌。
本次新纳入突破性疗法的申请针对的适应症是——依沃西联合吉西他滨和顺铂一线治疗晚期胆道癌。
目前,康方正在国内开展一项随机、对照、多中心头对头 III 期临床研究,以评估依沃西联合化疗 VS 度伐利尤单抗联合化疗一线治疗晚期胆道癌的有效性合安全性。该研究正在进行中,主要指标预计将在 2026 年 10 月完成。
2022 年 12 月,康方以 50 亿美金+2 位数百分比销售提成的方案,将依沃西部分海外权益许可给美国 Summit 公司。2026 年 1 月,Summit 已向 FDA 提交了依沃西的生物制品许可申请(BLA),适应症为联合化疗治疗第三代 EGFR-TKI 治疗进展的 EGFR 突变的非鳞状 NSCLC。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..