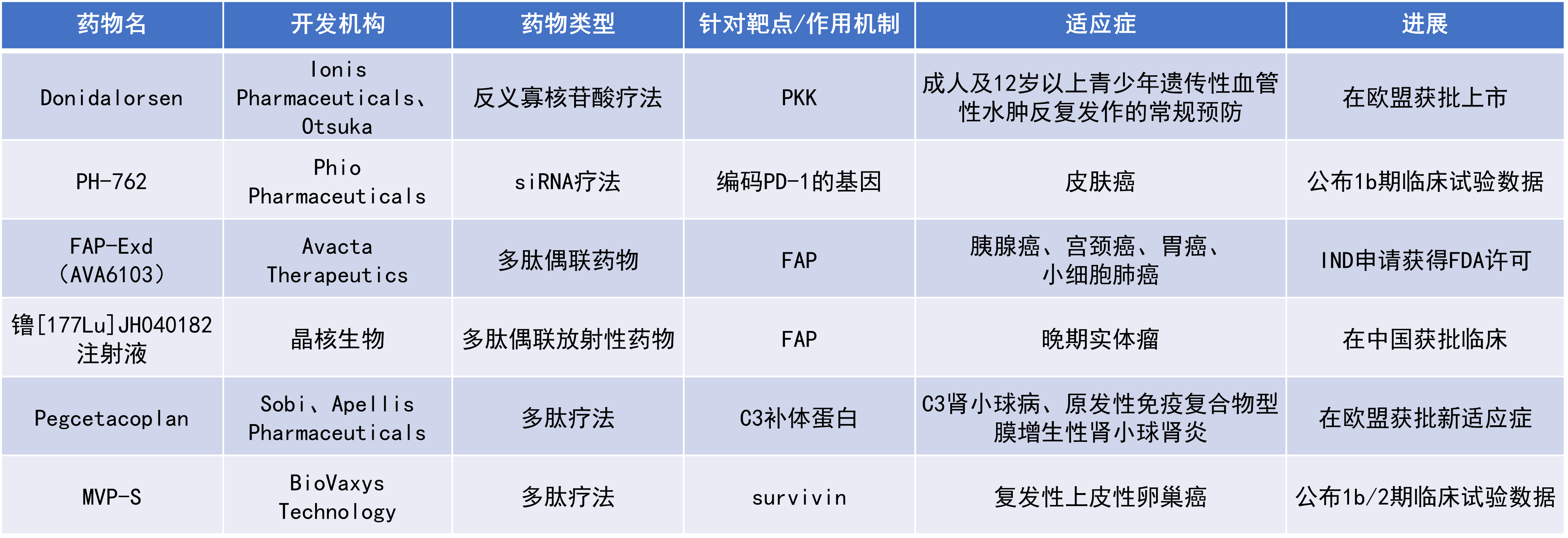
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。双环肽疗法Aspaveli(pegcetacoplan)在欧盟获批新适应症。用于治疗皮肤癌的小干扰RNA(siRNA)疗法在早期临床试验中表现亮眼,皮肤鳞状细胞癌(cSCC)患者的总缓解率(ORR)达70%。癌症疫苗maveropepimut-S(MVP-S)联合pembrolizumab及环磷酰胺治疗复发性上皮性卵巢癌(EOC),在一项早期临床试验中的疾病控制率(DCR)达82%。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Pegcetacoplan:在欧盟获批新适应症
Sobi宣布,欧盟委员会(EC)已批准其与Apellis Pharmaceuticals联合开发的Aspaveli(pegcetacoplan),用于与肾素-血管紧张素系统(RAS)抑制剂联合治疗12至17岁青少年及成人C3肾小球病(C3G)或原发性免疫复合物型膜增生性肾小球肾炎(IC-MPGN)患者;对于对RAS抑制剂不耐受或存在用药禁忌的患者,则可在不联合使用该类药物的情况下接受治疗。Pegcetacoplan是一款靶向C3补体蛋白的聚乙二醇化(PEGylated)双环肽疗法。双环肽分子集抗体、小分子药物及肽类的特性于一身,具有与抗体类似的亲和性和精确的靶向特异性;同时,由于它们分子量较小,使得其能够快速深入地渗透组织。2021年5月,pegcetacoplan获FDA批准用于治疗阵发性睡眠性血红蛋白尿症(PNH),商品名Empaveli。2025年7月,pegcetacoplan获FDA批准扩展适应症,用于治疗C3G及原发性IC-MPGN,以减少患者蛋白尿。
此次在欧盟获批主要基于3期VALIANT研究的积极结果。研究显示,pegcetacoplan在多个关键疾病指标上均带来积极且具有临床意义的获益,包括使蛋白尿水平下降68%、帮助维持肾功能稳定,并显著清除肾脏中的C3补体沉积。进一步分析表明,这些疗效在不同患者亚组中均保持一致,包括C3G与原发性IC-MPGN患者、成人与青少年人群,以及原发肾脏疾病与肾移植后复发疾病患者,均观察到相近的获益表现。
PH-762:公布1b期临床试验数据
Phio Pharmaceuticals公司公布了其siRNA疗法PH-762在治疗皮肤癌的1b期临床试验中的积极结果。PH-762是利用该公司专有的INTASYL基因沉默技术开发的化合物,旨在沉默与各种类型皮肤癌有关编码PD-1的基因。
在该研究中,22名皮肤癌患者完成了治疗,并接受了病灶部位的切除手术。20例皮肤鳞状细胞癌患者中,10例达到完全缓解(CR,病灶清除率达100%),2例达到接近CR(病灶清除率超过90%),以及2例部分缓解(PR,病灶清除率超过50%)。1例转移性默克尔细胞癌患者也实现了PR。有6例cSCC患者和1例黑色素瘤患者的病灶清除率低于50%,但所有患者均未出现疾病进展。所有接受瘤内注射PH-762的患者均未发生剂量限制性毒性或临床相关的治疗伴发不良事件。
Maveropepimut-S:公布1b/2期临床试验数据
BioVaxys Technology公司宣布其PESCO研究取得积极初步结果。该研究是一项由研究者发起、开放标签、非随机的1b/2期临床试验,旨在评估其DPX平台开发的多肽疫苗maveropepimut-S联合pembrolizumab及环磷酰胺在复发性上皮性卵巢癌患者中的安全性和疗效。MVP-S递送来自survivin家族的抗原肽、一种先天免疫激活剂和一种通用的CD4阳性T细胞辅助肽,旨在诱导特异性细胞毒性T细胞反应。由于survivin在卵巢癌等肿瘤中高表达而在正常组织中几乎不表达,使其成为理想的免疫治疗靶点。
该研究共纳入47例患者,所有患者接受至少两年随访。ORR为24%,DCR达82%,中位缓解持续时间为5.5个月。值得注意的是,铂敏感患者的表现尤为突出,ORR达40%,DCR达90%。即使在铂耐药患者中,ORR也达16%,DCR为54%,优于标准单药化疗约11.8%的历史ORR。一名铂敏感患者实现CR并持续3年,其检测到的免疫应答长达195周。MVP-S在62%的可评估患者中成功诱导survivin特异性免疫应答,且该应答与93%患者的疾病控制相关。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..