近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。礼来(Eli Lilly and Company)公布了其潜在“first-in-class”三靶点减重多肽疗法retatrutide的积极3期临床试验结果,患者治疗68周后,平均减重最高达28.7%。赛诺菲(Sanofi)宣布其用于治疗血友病的小干扰RNA(siRNA)疗法芬妥司兰钠注射液(商品名:赛菲因)已正式获得中国国家药品监督管理局(NMPA)批准上市。Enterome公司基于肿瘤肽的免疫疗法EO2463联用利妥昔单抗一线治疗低肿瘤负荷滤泡性淋巴瘤患者,在一项2期临床试验中的客观缓解率(ORR)达100%。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
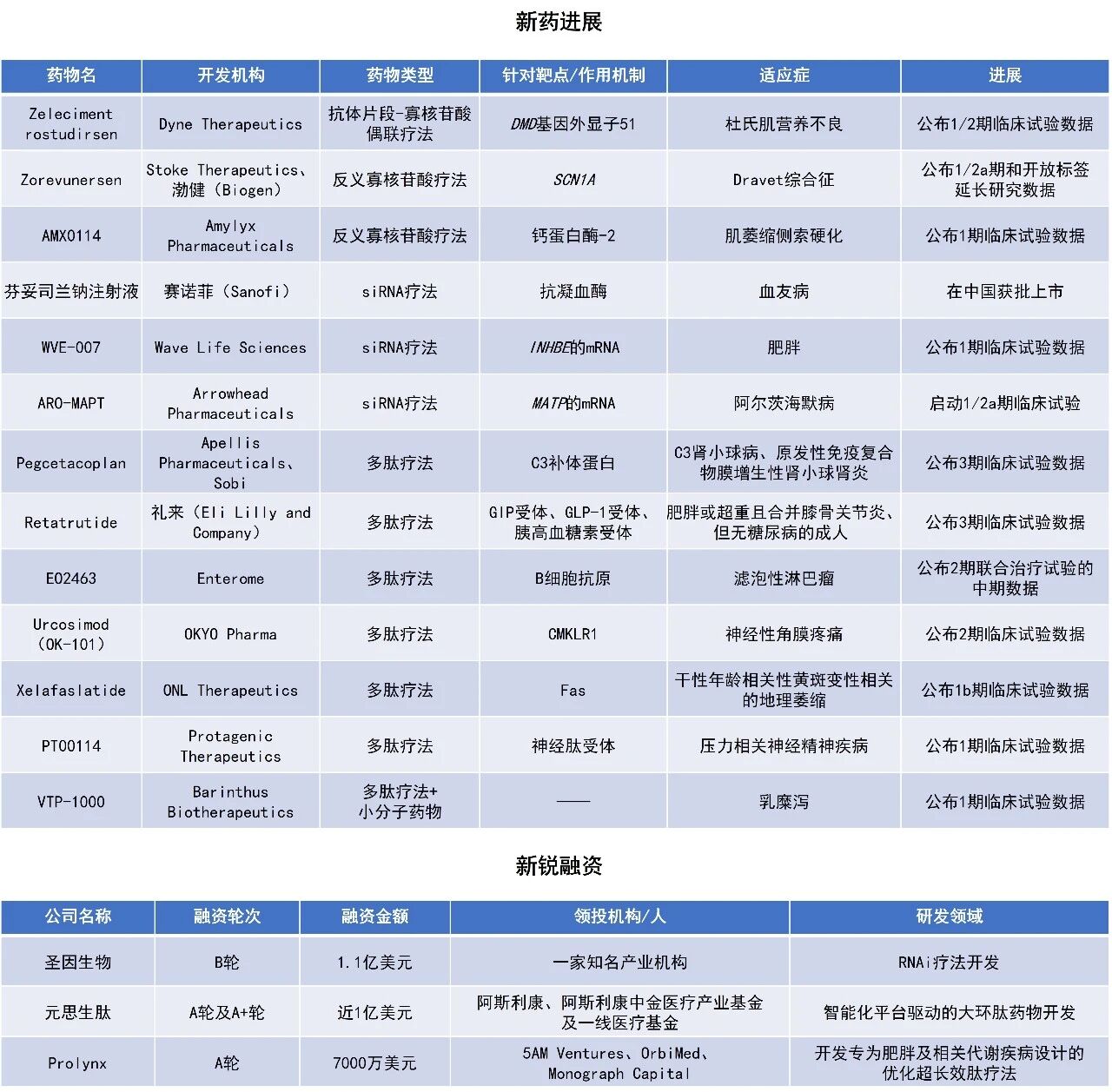
Retatrutide:公布3期临床试验数据
礼来宣布,其TRIUMPH-4临床3期试验取得积极的主要研究结果。该试验评估其在研、每周一次、潜在“first-in-class”葡萄糖依赖性促胰岛素多肽(GIP)、GLP-1和胰高血糖素(glucagon)受体靶向三重激动剂retatrutide,在患有肥胖或超重且合并膝骨关节炎、但无糖尿病的成年人中,作为健康饮食与运动的辅助治疗方案时的安全性和有效性。
在共同主要终点中,基于有效性估计目标评估,retatrutide可平均降低体重最多达28.7%(71.2磅),基于WOMAC疼痛评分平均降低疼痛最多达4.5分(75.8%),并显著改善身体功能指标。在试验结束时,超过八分之一接受retatrutide治疗的患者完全无膝部疼痛。在额外的次要终点方面,retatrutide降低了已知心血管风险标志物。Retatrutide的不良事件类型与其他肠促胰素类药物临床试验中观察到的情况一致。礼来预计将在2026年完成另外七项评估retatrutide用于肥胖和2型糖尿病治疗的3期临床试验。
芬妥司兰钠注射液:在中国获批上市
赛诺菲宣布,其创新非因子疗法芬妥司兰钠注射液已正式获得NMPA批准上市,适用于患有以下疾病的12岁及以上儿童和成人患者的常规预防治疗,以防止出血或降低出血发作的频率:存在或不存在凝血因子VIII抑制物的重型A型血友病(先天性凝血因子VIII缺乏,FVIII<1%)或存在或不存在凝血因子IX抑制物的重型B型血友病(先天性凝血因子IX缺乏,FIX<1%)。通过降低抗凝血酶(AT),芬妥司兰钠注射液可促使凝血酶生成增加,从而恢复血友病患者的凝血功能。新闻稿指出,芬妥司兰钠注射液是血友病领域首个通过降低AT水平实现治疗的药物,每年仅需最少六次皮下注射,可通过预充注射笔或西林瓶与注射器进行给药,从而为患者提供持续稳定的保护。
此次获批主要基于3期临床研究ATLAS的数据。研究结果表明,与按需治疗相比,接受芬妥司兰钠注射液治疗的患者,无论是否伴有抑制物,均显示出显著疗效:合并抑制物患者平均年化出血率(ABR)降低73%,无抑制物患者ABR降低71%。芬妥司兰钠注射液的不良反应包括血栓事件、急性及复发性胆囊疾病(部分患者可能行胆囊切除)以及肝毒性。最常见的不良反应(发生率超过10%)为病毒感染、鼻咽炎和细菌感染。
EO2463:公布2期联合治疗试验的中期数据
Enterome公司公布了其基于肿瘤肽的免疫疗法EO2463与利妥昔单抗联用治疗低肿瘤负荷滤泡性淋巴瘤的积极2期临床结果。EO2463由4种模拟B细胞肿瘤相关抗原CD20、CD22、CD37和CD268(BAFF受体)的多肽以及辅助性的UCP2肽组成,能够激活抗肿瘤免疫反应,清除癌变B细胞。
此次公布的结果显示,在队列3中,EO2463联合利妥昔单抗一线治疗初治的低肿瘤负荷滤泡性淋巴瘤患者,客观缓解率为100%(6/6),5名患者为完全缓解(CR),1名为部分缓解(PR)。达到客观缓解的中位时间为17周,到CR的中位时间为18周。此外,在EO2463单药治疗的初治滤泡性淋巴瘤患者(队列2)中,ORR为52.6%。
Zeleciment rostudirsen:公布1/2期临床试验数据
Dyne Therapeutics公司宣布,其在研疗法zeleciment rostudirsen在1/2期DELIVER试验的注册性扩展队列(REC)中,用于适合外显子51跳跃治疗的杜氏肌营养不良症(DMD)患者时取得了积极顶线结果。Zeleciment rostudirsen(z-rostudirsen,也称为DYNE-251)由磷酸二氨基甲酰吗啉寡核苷酸(PMO)与靶向转铁蛋白受体1(TfR1)的抗体片段(Fab)偶联而成。TfR1在肌肉组织中高度表达。该疗法旨在实现靶向肌肉组织递送,促进核内外显子跳跃,从而使肌肉细胞生成截短但功能正常的抗肌萎缩蛋白,目标是停止或逆转疾病进展。该疗法此前已被FDA授予快速通道资格、孤儿药资格、罕见儿科疾病认定,以及突破性疗法认定。Dyne表示其预计在2026年第二季度向美国FDA递交加速批准的上市申请目前进展良好。
分析显示,REC达到试验主要终点,显示在六个月时,与基线相比,zeleciment rostudirsen组患者肌肉含量调整后的抗肌萎缩蛋白(dystrophin)表达提高到正常水平的5.46%(p<0.0001),且具有统计学显著性。此结果重现了此前在注册剂量观察到的抗肌萎缩蛋白相较基线增加7倍的变化。
此外,在REC的顶线结果中,所有六项预定的功能性终点相对安慰剂均观察到改善。其中两项指标——起身时间(TTR)速度和10米行走/跑步(10MWR)速度——在六个月时相对安慰剂均有改善,且p<0.05。值得注意的是,以用力肺活量预测百分比(FVC%p)衡量接受治疗患者的肺功能时发现(在DMD中肺功能丧失是主要死亡原因),zeleciment rostudirsen组患者的肺功能在六个月时得到维持,而安慰剂组出现下降。该疗法持续展现良好的安全性和耐受性。
WVE-007:公布1期临床试验数据
Wave Life Sciences公司宣布,其正在开展的首次人体试验INLIGHT中,最低治疗剂量队列已取得积极中期结果,该试验主要评估在研疗法WVE-007用于肥胖治疗的潜力。WVE-007是一款长效GalNAc修饰siRNA,可靶向遗传学验证靶点INHBE的mRNA,旨在通过抑制INHBE表达减少脂肪累积,同时维持肌肉质量。INHBE基因主要在肝脏中表达,其编码的Activin E蛋白参与脂肪代谢调控,因此INHBE已成为改善肥胖治疗的高潜力靶点。
本次中期分析结果显示,在三个月时,相较基线,单次240 mg皮下注射WVE-007可使内脏脂肪减少9.4%(p=0.02),全身脂肪减少4.5%(3.5磅,p=0.07),瘦体重增加3.2%(4.0磅,p=0.01),而安慰剂组则未见具有统计学意义的变化。试验结果还显示,受试者血清中的Activin E持续且显著受到抑制,有望带来身体组成的持续改善、进一步减脂并维持肌肉量。整体来看,该药物安全性良好,仅观察到轻度治疗相关不良事件,实验室检测指标(包括血脂和肝功能)未见具有临床意义的异常变化。这一结果为WVE-007有望实现每年给药一至两次的给药方案提供了重要依据。
圣因生物完成超1.1亿美元B轮融资
聚焦RNAi疗法开发的临床阶段生物技术公司圣因生物宣布已完成超1.1亿美元B轮融资,募集资金将用于依托公司RNAi药物研发平台——包括LEAD(Ligand and Enhancer Assisted Delivery,新型配体与增效基团协同递送)肝外递送平台,推动临床阶段管线进入注册研究,并加速多个治疗领域在研管线的开发。
该B轮融资由一家知名产业机构领投,一家国际主权基金、中国生物制药集团、君联资本、维梧资本、Invus、SymBiosis、苏创投、真脉投资、清池资本跟投,并获礼来公司战略投资。同时,现有股东高瓴创投、启明创投、险峰淇云、泰福资本、元禾控股、北极光创投等继续支持。
公开资料显示,圣因生物依托GalNAc肝脏递送平台和LEAD肝外递送平台,致力于解决肥胖症、心血管代谢疾病和免疫介导性疾病领域等重大未满足的临床需求。LEAD平台能够高效地将siRNA特异性递送至脂肪、肌肉、免疫细胞及中枢神经系统等肝外组织,实现对致病基因高效、安全且持久的沉默,并大幅降低给药频率。圣因生物已建立快速增长的在研产品管线,目前已有4款临床阶段候选药物(1项临床2期,3项临床1期)及多个临床前管项目。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..