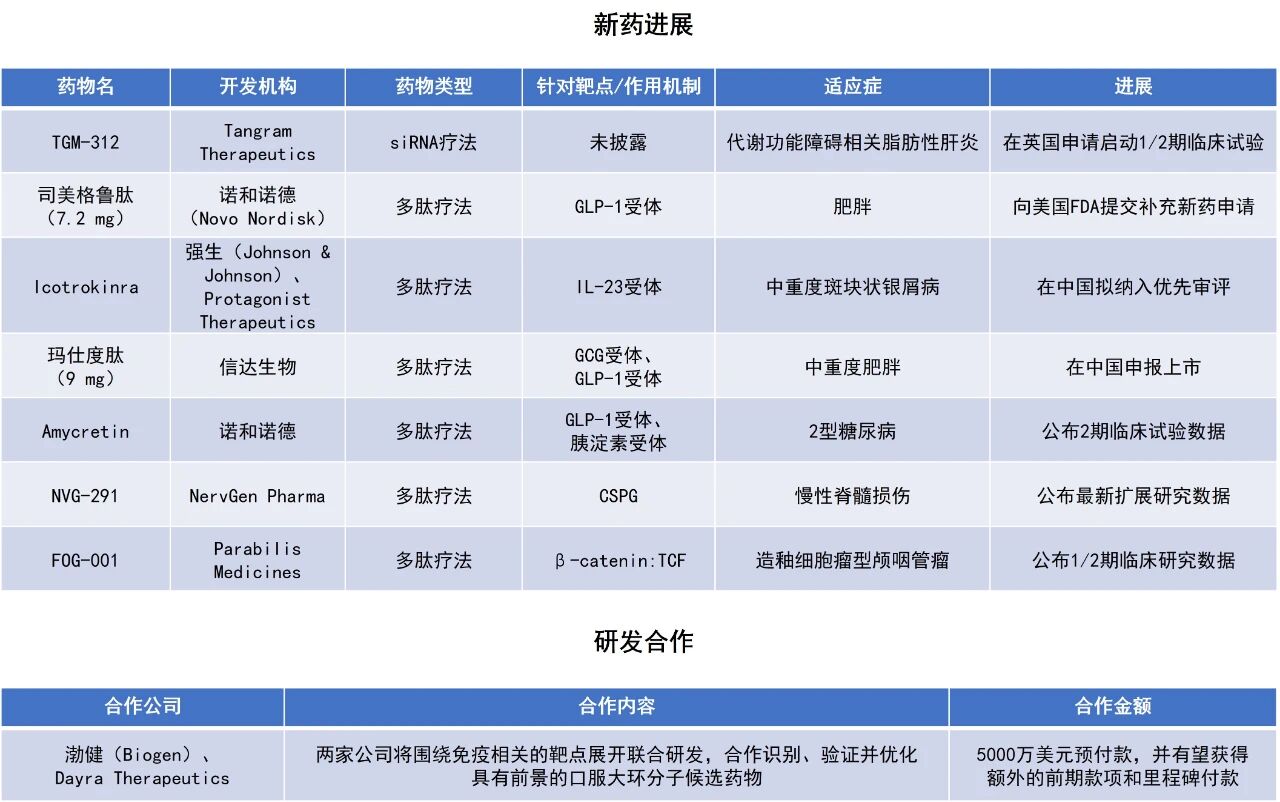
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。诺和诺德(Novo Nordisk)向美国FDA提交了7.2 mg Wegovy(semaglutide,司美格鲁肽)注射剂的补充新药申请(sNDA)。靶向“不可成药”靶点的多肽疗法FOG-001公布亮眼临床数据,3名造釉细胞瘤型颅咽管瘤患者均出现肿瘤缩小。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
司美格鲁肽:向美国FDA提交补充新药申请
诺和诺德宣布,已向美国FDA提交7.2 mg Wegovy(semaglutide,司美格鲁肽)注射剂的sNDA,拟用于联合低热量饮食和增加体力活动,以帮助肥胖成人进行长期体重管理。7.2 mg Wegovy的监管申请也正在接受欧洲药品管理局(EMA)审评,预计2026年第一季度公布结果。Wegovy是一种GLP-1受体激动剂,它能够刺激胰岛素的生成,并抑制胰高血糖素分泌,降低食欲和食物摄入量。2021年6月,FDA批准其用于治疗普通肥胖患者,它是自2014年以来美国FDA批准的首款用于控制普通肥胖症或超重的新药。该药物并在同年晚些时候再获欧盟批准治疗肥胖适应症。
本次申请主要基于来自STEP UP的研究结果,这是一项为期72周的3期、随机、双盲、安慰剂对照试验,入组1407名身体质量指数(BMI)≥30 kg/m²的肥胖成年人,患者均无糖尿病史。试验结果显示,在患者依从治疗的前提下,每周一次7.2 mg Wegovy使患者(基线平均体重249磅)在72周后实现了平均20.7%的体重下降,明显优于接受2.4 mg剂量患者的17.5%降幅及安慰剂组的2.4%。此外,33.2%的7.2 mg组患者体重降幅达到或超过25%,远高于2.4 mg组的16.7%与安慰剂组的0%。在将中途停药者纳入分析后,7.2 mg组患者的平均体重下降仍达18.7%,同样优于2.4 mg组的15.6%与安慰剂组的3.9%。此外,7.2 mg组中有90.7%的患者实现≥5%体重下降,亦高于2.4 mg组的89.9%和安慰剂组的36.8%。
FOG-001:公布1/2期临床研究数据
Parabilis Medicines公司公布了其在研疗法FOG-001的新临床数据,该疗法靶向此前被认为是“不可成药”的Wnt/β-catenin信号通路中的关键节点——β-catenin与T细胞因子(TCF)的相互作用。该通路是30多年前发现的核心致癌驱动因素,每年与数百万癌症病例相关,但目前尚无针对它的获批疗法。FOG-001是该公司基于其Helicon肽平台开发的候选药物,通过阻断β-catenin与TCF转录因子家族的结合,直接抑制由Wnt通路激活驱动的肿瘤形成。该平台利用稳定的α-螺旋肽,克服了传统小分子药物的局限性,能够进入细胞并与相对平坦的蛋白质表面紧密结合。
在一项针对多种Wnt/β-catenin驱动肿瘤的1/2期临床试验中,截至2025年8月11日的数据,已有3名患有造釉细胞瘤型颅咽管瘤并伴有视野缺损的患者接受了FOG-001治疗。所有3例患者均出现肿瘤缩小,且安全性良好、耐受性可控。其中2例患者达到部分缓解(PR),肿瘤体积分别缩小了56.0%和48.0%;另1例患者病情稳定,肿瘤体积缩小了19.2%。截至目前,未报告任何与治疗相关的严重不良事件、剂量减少或治疗中断。
Amycretin:公布2期临床试验数据
诺和诺德公司宣布,其在研新药amycretin在2型糖尿病患者中取得了积极的2期临床试验顶线结果。Amycretin是一款由诺和诺德开发的单分子、长效GLP-1和胰淀素受体激动剂,设计用于每周一次皮下注射及每日一次口服使用,旨在为超重或肥胖成人提供高效且便捷的治疗方案,同时也用于治疗2型糖尿病。
该2期试验共纳入448名2型糖尿病患者,旨在评估不同剂量amycretin对比安慰剂的疗效、安全性和药代动力学。这些患者尽管接受了标准治疗(使用二甲双胍,且可能合并或不合并SGLT2抑制剂),但其血糖控制仍然不足。结果显示,治疗36周后,amycretin组实现最高达14.5%的显著体重减轻,并带来具有统计学意义的糖化血红蛋白(HbA1c)降低,HbA1c达到<7和≤6.5个百分点的比例最高分别为89.1%和76.2%。安全性方面,皮下注射与口服amycretin均表现出良好的安全性和耐受性,与其他肠促胰岛素及胰淀素相关疗法一致。最常见的不良事件为胃肠道反应,绝大多数为轻中度。
玛仕度肽:在中国申报上市
信达生物宣布,其GCG/GLP-1双受体激动剂玛仕度肽注射液高剂量9 mg用于成人中重度肥胖患者长期体重控制的上市申请已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理。玛仕度肽有望在减重手术之外,为中国中重度肥胖人群提供一个强效、安全的新治疗选择。本次上市申请基于玛仕度肽9 mg在中国中重度肥胖人群中开展的3期注册临床研究GLORY-2的结果。该研究近期达成了主要终点和所有关键次要终点。
玛仕度肽(IBI362)是信达生物与礼来共同推进的一款GCG/GLP-1双受体激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动GLP-1R促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。玛仕度肽已在多项临床研究中展现出优秀的减重和降糖疗效,并能降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。
TGM-312:在英国申请启动1/2期临床试验
Tangram Therapeutics公司宣布,已向英国药品和保健品监管局(MHRA)提交临床试验申请(CTA),旨在启动其主打候选药物TGM-312的1/2期临床试验。TGM-312是一种基于Tangram Therapeutics公司专有的RNAi化学平台GalOmic开发的GalNAc偶联小干扰RNA(GalNAc-siRNA),旨在特异性沉默肝细胞中一个新靶点基因,用于治疗代谢功能障碍相关脂肪性肝炎(MASH)。该药物有望实现每季度一次的皮下给药,提升患者用药便利性。
在具有高度转化性的Gubra-Amylin NASH饮食诱导肥胖(GAN-DIO)小鼠模型的临床前研究中,TGM-312单药或与已获批及在研MASH疗法联用,均能显著降低NAFLD活动评分(NAS)、减轻肝脏炎症并减缓纤维化进程。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..