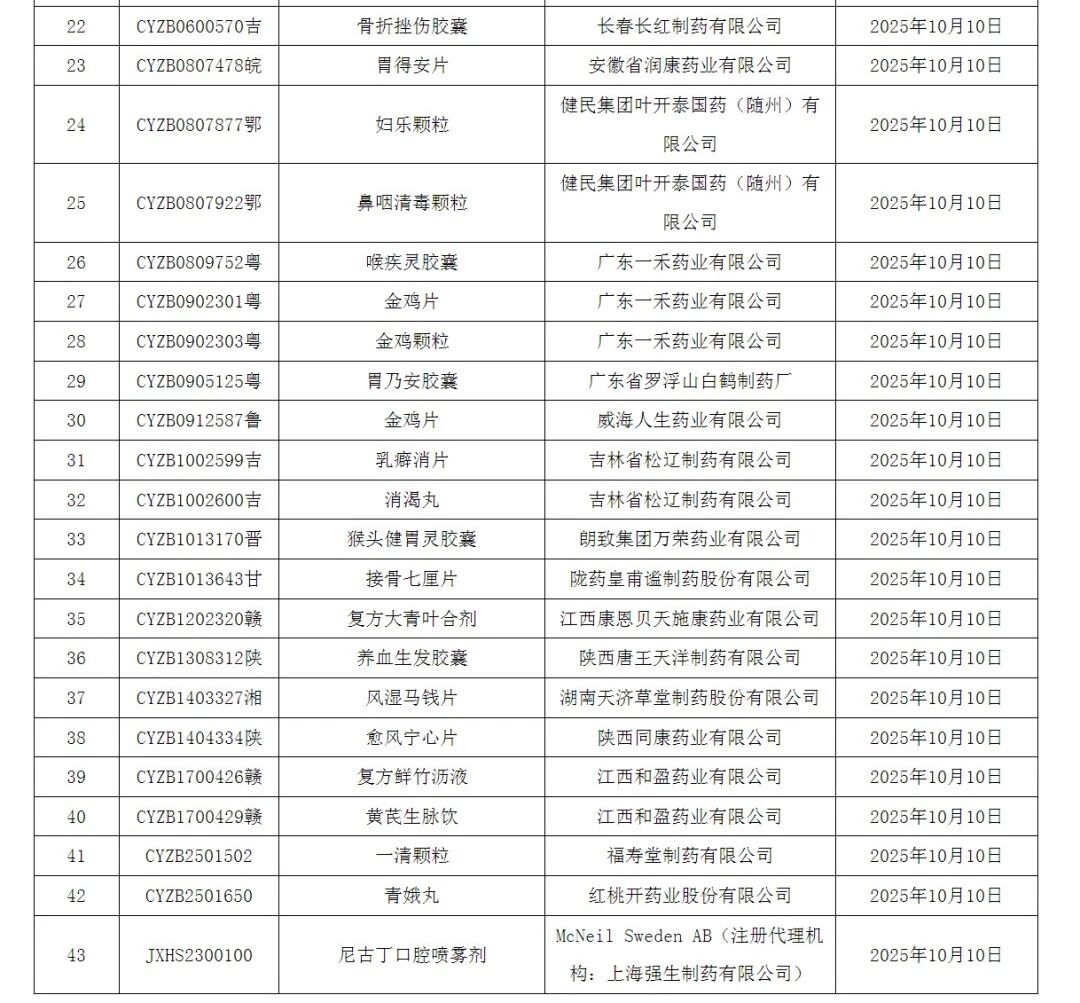
10月11日,NMPA下发了43条不带药品批号的“通知件”,意味着多款重磅品种上市失败。
国家药监局下发的通知件有多种含义,既可以是获批通过,也可能是发一个不予通过的通知,主要区别在于是否附带了批号。
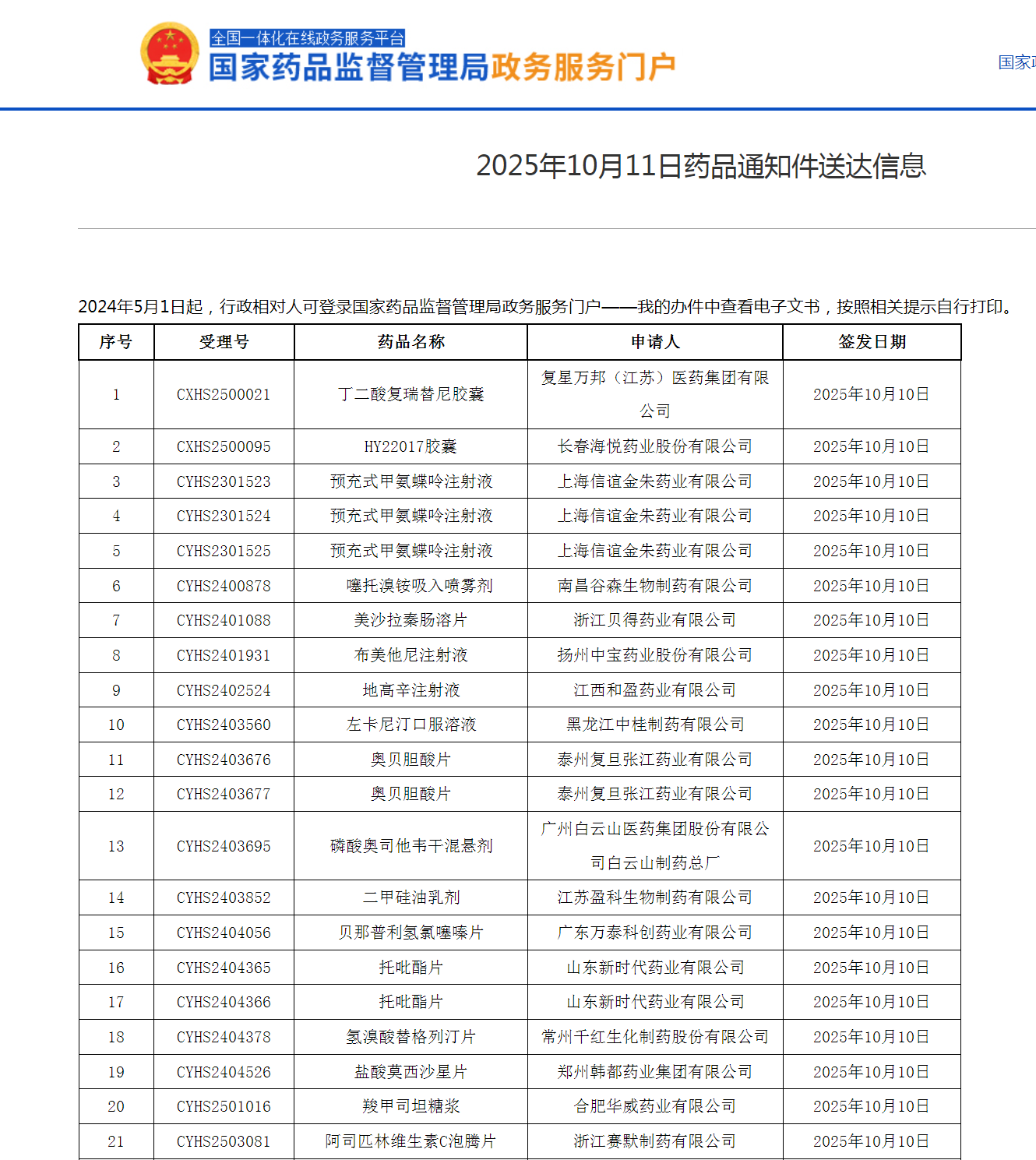
创新药方面:11日下发的通知件中,复星医药自研的1类肺癌新药丁二酸复瑞替尼胶囊、强生代理的尼古丁口腔喷雾剂等重磅产品在列。
仿制药方面:此前深陷原研撤市风波的奥贝胆酸,国内仿制接连被毙,仅剩复旦张江的两条受理号在审评流程,11日下发的通知件意味着奥贝胆酸仿制全军覆没。磷霉素氨丁三醇颗粒,则是收到了第六张通知件,未能获批。
基于近期通知件数量增加,业内猜测CDE审核趋严。另外,行业人数粗略统计了2023.01.01以来,未通过审批的比例中,新药的比例最高。
不予批准的原因,可能包括:
1)新药:
立题问题(如剂型或给药途径选择不合理、违背临床诊疗原则)、有效性数据不支持、存在安全性问题或隐患、临床试验设计不合理(如样本量不足、对照组选择不当、研究终点设置不科学)、质量可控性问题、改良型新药没有明显的临床优势、现场核查发现真实性问题/数据可靠性问题等。
2)仿制药:
不能豁免临床、参比制剂选择不合理、临床上规格选择不合理、原料质量研究问题导致制剂不予批准、工艺设计不合理(如应终端灭菌)、质量研究/稳定性研究缺陷、特殊品种集中处理劝退审、现场核查发现真实性问题/数据可靠性问题等。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..