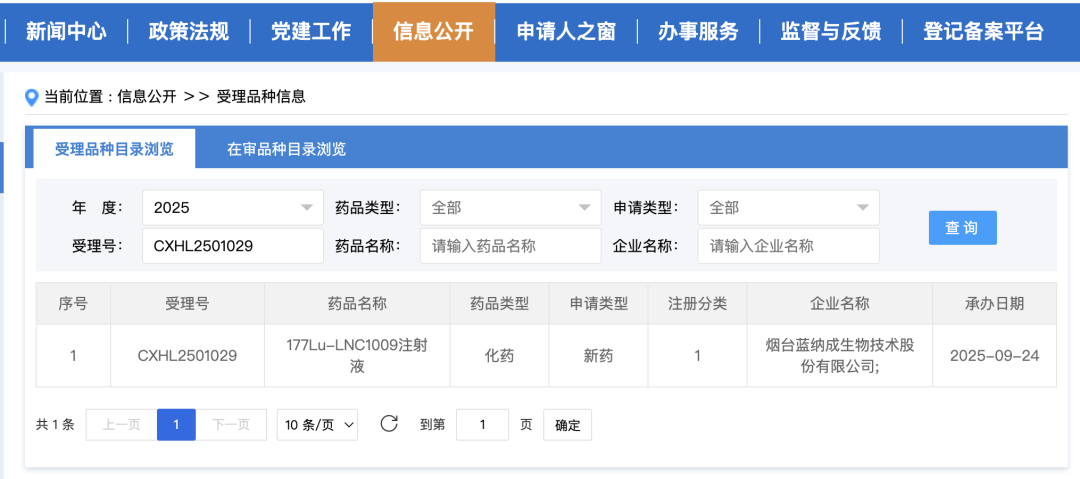
近日,国家药品监督管理局药品审评中心(CDE)官方网站公示信息显示,由烟台蓝纳成生物技术股份有限公司申报的"177Lu-LNC1009注射液"已获得获得国家药品监督管理局药品审评中心受理公开,受理号为CXHL2501029)。177Lu-LNC1009注射液(177Lu-FAPI-RGD)拟用于治疗FAP和/或αvβ3阳性的成人实体瘤患者。
此前的临床研究显示,在肺癌患者中,68Ga-LNC1009具有肿瘤高摄取,延长的肿瘤滞留时间和良好的肿瘤-背景比值(TBR);与18F-FDG及68Ga-RGD相比,68Ga-LNC1009PET/CT显示出更高的肺癌原发灶检出率、更高的肿瘤摄取和更好的转移灶检出表现;此外,双靶向FAP和αvβ3的18F-LNC1007注射液可以进一步提高肿瘤的诊断效率,在临床前研究和临床转化研究中,18F-LNC1007注射液能够显著延长肿瘤摄取时间、提升肿瘤靶向效率,并具有良好的肿瘤成像质量。有希望在未来成为一种非侵入性示踪剂用于FAP和/或αvβ3阳性表达患者的临床诊断。
根据蓝纳成公开信息显示,177Lu-LNC1009一种新型双靶点放射性体内治疗药物,同时靶向成纤维细胞活化蛋白(Fibroblast Activation Protein,以下简称“FAP”)和整合素αvβ3 (Integrin αvβ3,以下简称“αvβ3”),拟用于治疗FAP和/或αvβ3阳性的成人实体瘤。
关于蓝纳成
烟台蓝纳成生物技术股份有限公司成立于2021年,聚焦全球1类创新放射性药物的研发、注册和产业化,专注打造具有国际转化能力的诊疗一体化放射性药物产品管线,致力于为肿瘤患者提供更加精准和有效的治疗方案,推动核医学在全球的发展,是东诚药业核医疗生态圈中的关键一环。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..