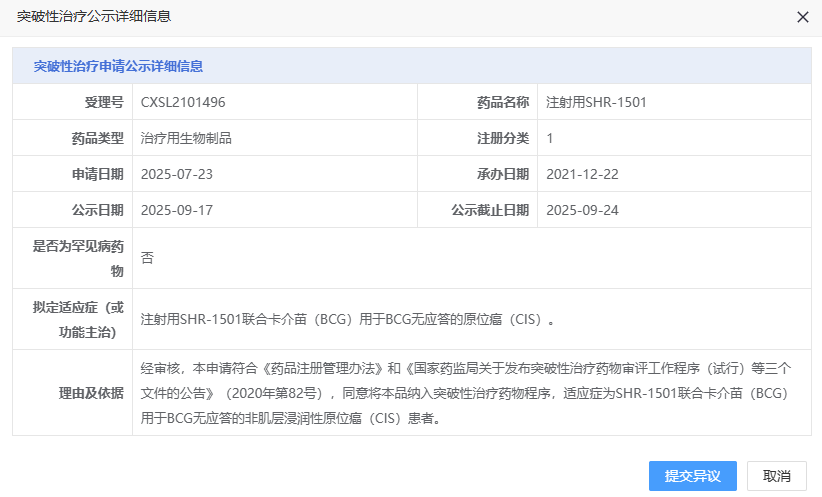
9 月 17 日,CDE 官网显示,恒瑞申报的 1 类新药注射用 SHR-1501 拟纳入突破性治疗品种,适应症为联合卡介苗(BCG)用于 BCG 无应答的原位癌(CIS)。
截图来源:CDE 官网
SHR-1501 是恒瑞医药自主研发的白细胞介素-15(IL-15)融合蛋白,可以刺激体内 T 细胞、B 细胞和 NK 细胞增殖,发挥调动机体免疫系统清除体内异物的作用。
在 2025 年 ASCO 大会上,恒瑞首次公布了 SHR-1501 的临床数据。数据来源于一项 SHR-1501 单药或与 BCG 联合用于治疗高危非肌层浸润性膀胱癌(NMIBC)的 I/II 期临床研究。
截至 2024 年 9 月 7 日,该研究共入组 84 名受试者,其中 Ia 期入组 8 名受试者(SHR-1501,200、400 和 600μg ),Ib 期入组 6 名受试者(SHR-1501+BCG), II 期入组 70 名受试者(SHR-1501+BCG)。
II 期共有 3 个队列,队列 A 为 BCG 初治 NMIBC 患者(n=29)、队列 B 为对 BCG 治疗无应答的原位癌患者(n=17),队列 C 则为 BCG 无应答的非原位高级别 Ta/T1 期 NMIBC 患者(n=24)。
在 Ia/Ib 期研究中,未观察到剂量限制性毒性(DLT),且未达到最大耐受剂量(MTD)。因此 II 期使用了 600μg SHR-1501 + 120mg BCG 治疗方案。
疗效方面,队列 B 在疗效可评估的患者中,3 个月或 6 个月的 CR 率为 90.9%(10/11)。在队列 A 和 C 中,12 个月的 DFS 数据尚未成熟。队列 A 的 9 个月 DFS 率为 94.4%,队列 C 的 9 个月 DFS 率为 53.9%。
安全性方面,SHR-1501 组治疗相关不良事件(TRAE)发生率为 50%(4/8),联合治疗组为 69.7%(53/76)。单药组和联合组 3 级 TRAE 发生率分别为 12.5% 和9.2%。未报告 4 级或 5 级 TRAE,未发生严重 TRAE。
总体而言,SHR-1501 单独使用或与 BCG 联合使用均具有良好的耐受性,并对未接受 BCG 治疗和对 BCG 无反应的高危 NMIBC 患者表现出良好的疗效,支持进一步研究。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..