FDA于8月22日宣布正式开始每日发布药品及生物制品的不良事件报告。此前,FDA不良事件报告系统(FAERS)每季度更新一次。
FDA局长Marty Makary在声明中表示:“不良事件报告应快速、无缝且透明...那些在政府笨重的(clunky)不良事件报告网站上查找信息的人,不应再等待数月才能看到这些信息公开。我们将缩短这一等待期,并继续简化从开始到结束的整个流程。”
该举反映了Makary改善产品上市后安全监测的意愿。他多次提及利用电子健康记录以更好地检测安全信号并评估产品有效性。他的上司卫生部长Robert F. Kennedy Jr.也多次强调改进该机构监测系统,尤其是疫苗监测系统。
FDA在公告中称,此次数据发布方式的转变,是FDA更广泛数据现代化战略中的众多步骤之一。该战略旨在简化FDA的所有不良事件报告系统,并增加所有系统的报告频率,以便更快地识别安全信号。
由下图可知,本文截稿时,FDA的FAERS系统在2025年共采集到1378777份不良反应报告。
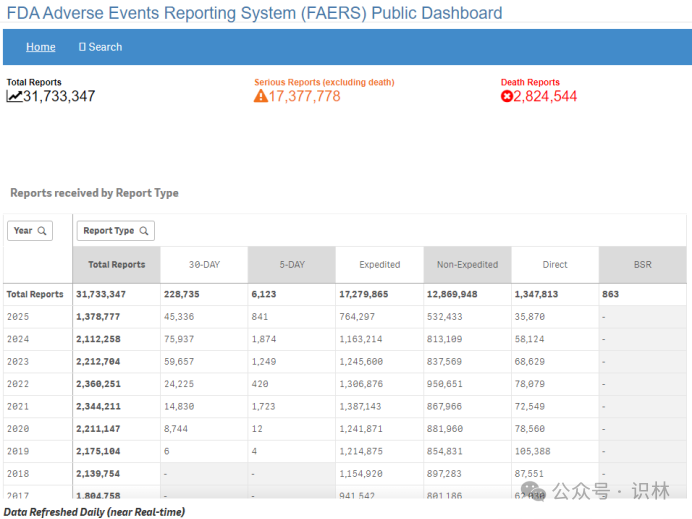
*截取自FAERS公共仪表盘
表格中不同类型报告的数据包括:
直接报告(Direct):由消费者和医疗专业人员通过MedWatch项目直接自愿提交。
强制报告:由制造商提交,分为以下几类:
加急报告(Expedited):包含至少一个未在产品标签中描述且结果严重的不良事件,或
非加急报告(Non-Expedited):不符合加急报告标准,包括被报告为严重且预期的、非严重且意外和非严重且预期的情况。
BSR报告:15天生物安全报告,直到2005年为止作为单独的报告类型提交。
30天报告:用于报告组合产品(包含药品和器械的产品)的故障问题。
5天报告:用于报告由组合产品引起的严重且意外的事件,需要采取补救措施以防止对公众健康造成重大伤害的不合理风险。
但这些统计数据离Makary所谓“信息公开”仍然有相当距离。曾在FDA从事上市后安全工作的专家向媒体表示,实时发布数据是朝着正确方向迈出的一步,但FAERS数据库并不包含解释患者具体发生情况的“叙述性”信息。这些信息只能通过信息自由法案(FOIA)请求获得。也就是说,每日更新仅包含数据,不包含任何实质内容,这一点并未改变。
该专家称:“除非FDA开始发布上下文信息,否则这并没有多大帮助。也许有些人希望每天都能了解情况。”
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..