7月18日,欧洲药品管理局(EMA)发布了2025年《监管科学研究需求》,向业界广而告之其最为关注的监管科学课题,通过沟通和资金等各种支持,吸引并鼓励研究人员填补监管科学领域的空白。
在2025年监管科学研究课题的结构和概述部分,文件详细列出了监管科学的研究需求,分为四个部分:一是改善临床研究;二是推动监管体系进化;三是促进特定类型药品开发的技术发展;四是专门推进动物健康和兽药监管。
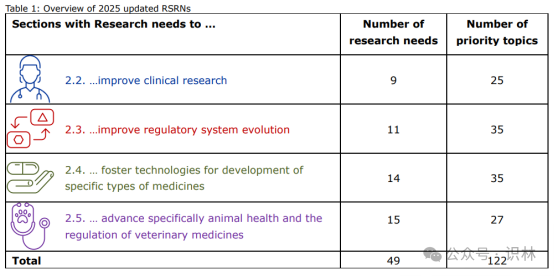
从上表和题图对比可以看出,总计49个需求,122项优先课题,数量最多的是监管体系和特定药品技术最多。临床需求数量并不多,但“临床试验”作为关键词却高频出现,可谓无处不在,仍然是最热点。
下面挑选临床、监管体系和特定药品中课题较多的几项需求,看看EMA的关注点,也可反观中美药监体系的相应进展,作为参考。完整课题列表可参见EMA文件原文。
临床研究方面,需求课题最多的是关于提升临床试验设计和分析方法效率的研究,包括:
对在平台试验中使用非同期治疗组的方法进行比较,包括时间趋势的处理。
研究分层/多级模型方法在复杂或个性化治疗试验的疗效终点分析中的应用。
针对药品与受试者特征中与“一类错误控制”相关的独立性特征的评估(例如,当这些特征被纳入平台试验的治疗组、阶段、分组或其他要素时)。
与利益相关者共同开发方案并准备开展多阶段或平台试验,该试验将建立新的早期疗效终点,并在未来试验参与者中使用该终点来研究试验产品的疗效(例如针对低发病率、高风险医院感染的疫苗)。
研究构建包含功能改善或损害以及有利或不利事件的有序终点的方法,并通过以往试验模拟其对试验效率的影响。
对首次人体肿瘤学研究的设计进行分析和基于模拟的比较,以评估其效率和患者获益-风险。
综述利益相关者关于多样性、公平性和包容性的立场和论点(涵盖伦理、政策、药理学、医学),分析其对各种活动的影响和意义,特别是临床研究和药品开发。
监管体系方面,关于药品监管路径、药品开发工具以及药品分类和定义方面课题较多,包括
研究新药品开发工具(及技术)的需求和机会,通过新的监管认可形式进行支持。
制定用于指导对阻断传播药物的监管评估和评价的标准。
确定影响监管机构对全球其他监管机构评估结果的信赖的参数。
深入研究间接比较药品对临床相关终点影响的方法学,包括贝叶斯方法,包括在罕见疾病领域的应用案例。
对国际上关于边界产品(borderline products,即可能具有药品、化妆品或保健品多种属性的产品)的分类和评估框架进行信息汇总和综述,描述其对不同利益相关方的影响。
对全球用于生物类似药评估的标准进行综述,包括临床开发(数据类型和数量)以及关键质量属性。
进行一项全球性的、定量的、地理相关的以及时间相关的分析,涵盖健康相关临床研究的类型,包括但不限于地区监管定义(例如,“研究”“试验”“低干预试验”以及卫生系统内的试验),目的是提供临床研究的全景图、研究分类/术语的总览,以及研究设计类型和与卫生系统的联系。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..