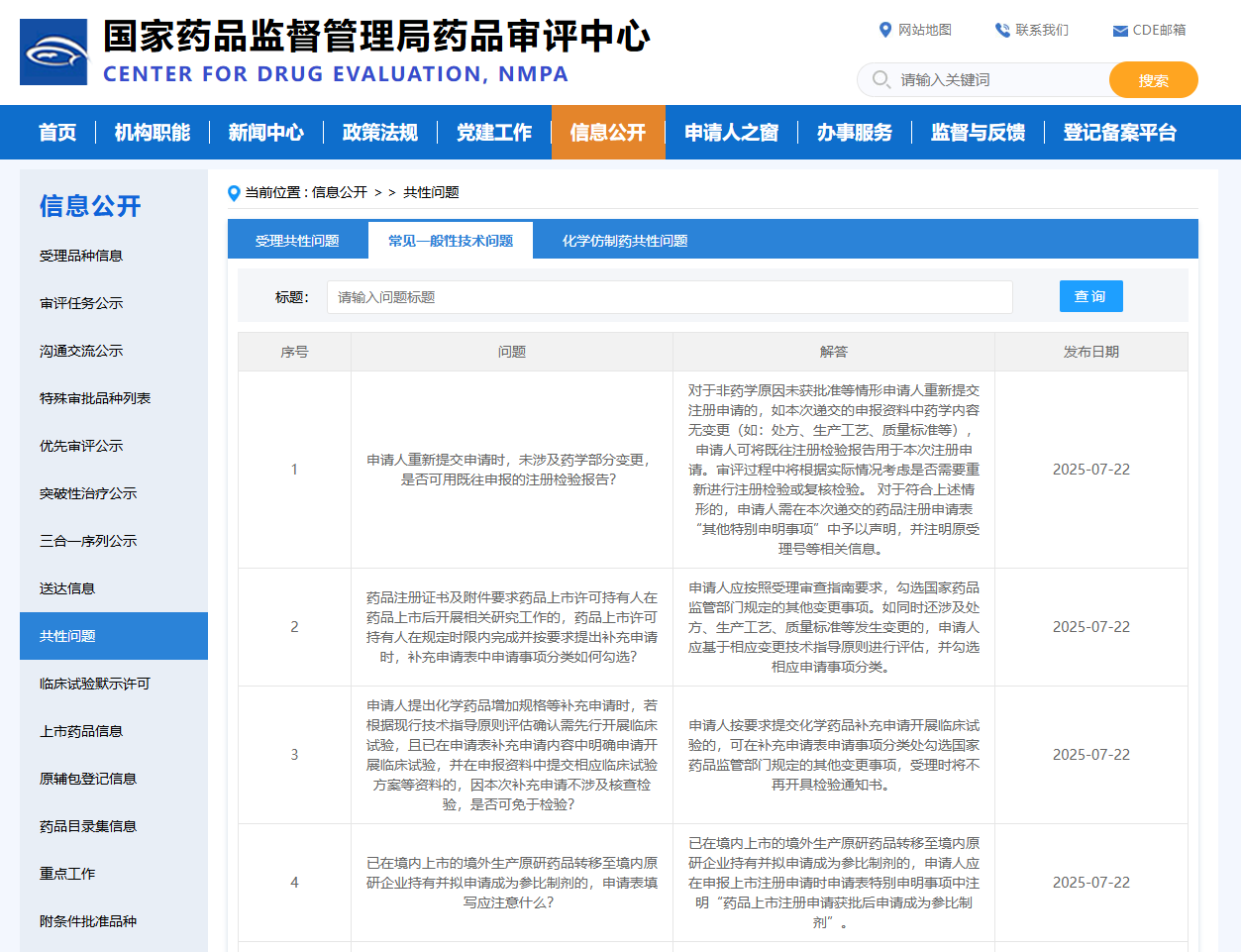
Q1:申请人重新提交申请时,未涉及药学部分变更,是否可用既往申报的注册检验报告?
A1:对于非药学原因未获批准等情形申请人重新提交注册申请的,如本次递交的申报资料中药学内容无变更(如:处方、生产工艺、质量标准等),申请人可将既往注册检验报告用于本次注册申请。审评过程中将根据实际情况考虑是否需要重新进行注册检验或复核检验。对于符合上述情形的,申请人需在本次递交的药品注册申请表“其他特别申明事项”中予以声明,并注明原受理号等相关信息。
Q2:药品注册证书及附件要求药品上市许可持有人在药品上市后开展相关研究工作的,药品上市许可持有人在规定时限内完成并按要求提出补充申请时,补充申请表中申请事项分类如何勾选?
A2:申请人应按照受理审查指南要求,勾选国家药品监管部门规定的其他变更事项。如同时还涉及处方、生产工艺、质量标准等发生变更的,申请人应基于相应变更技术指导原则进行评估,并勾选相应申请事项分类。
Q3:申请人提出化学药品增加规格等补充申请时,若根据现行技术指导原则评估确认需先行开展临床试验,且已在申请表补充申请内容中明确申请开展临床试验,并在申报资料中提交相应临床试验方案等资料的,因本次补充申请不涉及核查检验,是否可免于检验?
A3:申请人按要求提交化学药品补充申请开展临床试验的,可在补充申请表申请事项分类处勾选国家药品监管部门规定的其他变更事项,受理时将不再开具检验通知书。
Q4:已在境内上市的境外生产原研药品转移至境内原研企业持有并拟申请成为参比制剂的,申请表填写应注意什么?
A4:已在境内上市的境外生产原研药品转移至境内原研企业持有并拟申请成为参比制剂的,申请人应在申报上市注册申请时申请表特别申明事项中注明“药品上市注册申请获批后申请成为参比制剂”。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..