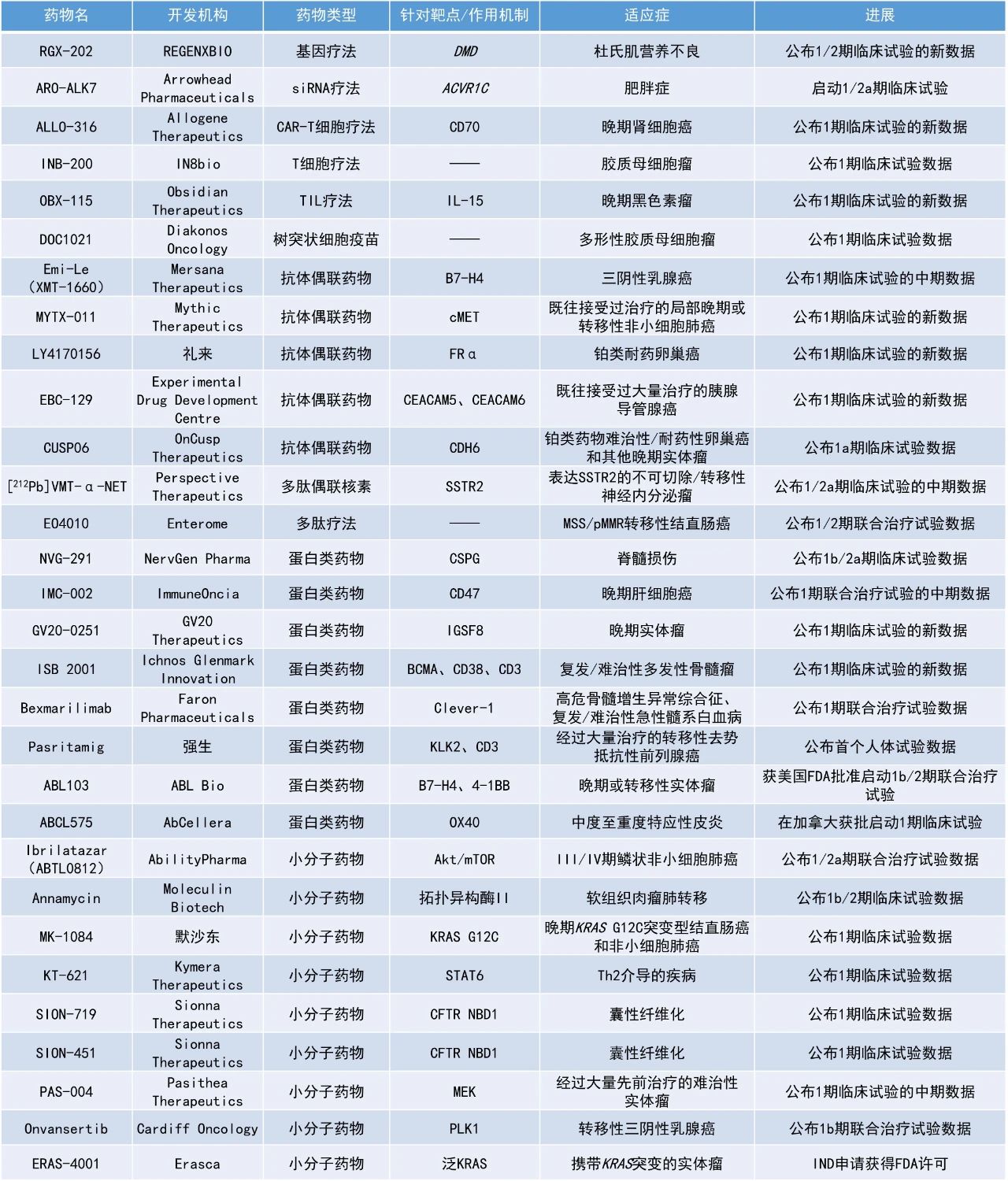
本期看点
Bexmarilimab:公布1期联合治疗试验数据
Faron Pharmaceuticals公司宣布,其靶向Clever-1的单克隆抗体bexmarilimab的一项1期研究结果已发表在《柳叶刀-血液学》(Lancet Haematology)杂志上。该研究旨在评估bexmarilimab联合SoC治疗高危骨髓增生异常综合征和复发/难治性(r/r)急性髓系白血病(AML)患者的安全性和有效性。Bexmarilimab是Faron公司全资拥有的研究性免疫疗法,旨在通过靶向髓系细胞功能和激活免疫系统,克服对现有疗法的耐药性并优化临床疗效。Bexmarilimab能与巨噬细胞上的免疫抑制受体Clever-1结合,该受体有助于肿瘤生长和转移(即帮助癌症躲避免疫系统)。通过靶向巨噬细胞上的Clever-1受体,bexmarilimab可改变肿瘤微环境,将巨噬细胞从免疫抑制(M2)状态重编程为免疫刺激(M1)状态,上调干扰素的产生,启动免疫系统攻击肿瘤,使癌细胞对标准治疗敏感。
此次公布的结果显示,bexmarilimab联合阿扎胞苷在初治和低甲基化药物(HMA)治疗失败的HR-MDS患者中的ORR分别为100%和89%。HMA治疗失败的MDS患者的估计中位OS为13.4个月,r/r AML患者为8.1个月。两名HMA治疗失败的MDS患者在治疗后接受了造血干细胞移植(HSCT)。此外,治疗后患者的骨髓免疫生物标志物较基线水平提升了近3倍。在67%的HMA治疗失败的MDS患者中观察到HLA-DR分子增加,进一步支持bexmarilimab的作用机制。安全性方面,bexmarilimab联合治疗的耐受性良好,未观察到剂量限制性毒性。大多数治疗伴发不良事件(TEAE)为轻度至中度,仅6%与bexmarilimab相关。
Ibrilatazar(ABTL0812):公布1/2a期联合治疗试验数据
AbilityPharma公司宣布,其评估ibrilatazar(ABTL0812)联合化疗(紫杉醇/卡铂)治疗III/IV期鳞状非小细胞肺癌患者的1/2a期临床试验ENDOLUNG的数据已发表在Lung Cancer杂志上。Ibrilatazar是一种潜在“first-in-class”、差异化的口服靶向抗癌化合物,通过诱导内质网应激和抑制PI3K/Akt/mTOR通路来引发自噬。在临床试验中,ibrilatazar对子宫内膜癌和肺癌患者显示出临床益处。此外,它在包括肺癌、子宫内膜癌、胰腺癌、神经母细胞瘤和胶质母细胞瘤等癌症类型的动物模型中展示了强有力的临床前概念验证。
此次公布的结果显示,与历史对照相比,ibrilatazar联合化疗在所有疗效终点均显示出改善,包括:ibrilatazar联合治疗组的总缓解率为52%,历史对照为31.7%;ibrilatazar联合治疗组的中位无进展生存期(PFS)为6.2个月,历史对照为4.2个月;ibrilatazar联合治疗组的中位OS为22.5个月,历史对照为11.3个月。安全性方面,ibrilatazar联合化疗表现出良好的安全性。在紫杉醇/卡铂基础上加入ibrilatazar的安全性与历史对照中紫杉醇/卡铂单独使用时的安全性一致,并未带来除紫杉醇/卡铂本身已知不良事件之外的显著新增安全性风险。
KT-621:公布1期临床试验数据
Kymera Therapeutics公司公布其潜在“first-in-class”口服STAT6降解剂KT-621在1期健康受试者研究中的积极结果。数据显示,KT-621在每日一次口服给药下,于所有高于1.5 mg剂量水平中实现了超过90%的平均血液STAT6降解;在所有≥50 mg的MAD组中,更在血液与皮肤中均达成完全降解。此外,KT-621对Th2炎症相关生物标志物TARC和Eotaxin-3的中位降低幅度分别高达37%与63%,表现优于或相当于现有获批药物。
KT-621在本项试验中展现出优异的安全性,未观察到严重不良事件或与治疗相关的不良事件,整体耐受性与安慰剂无明显差异。Kymera公司指出,KT-621的临床表现已显著优于其预设的产品特征目标,进一步验证了其“生物制品口服化”开发策略的可行性。当前,KT-621正在中重度特应性皮炎(AD)患者中开展1b期BroADen试验,预计将在2025年第四季度公布数据,并计划分别于2025年第四季度与2026年第一季度启动针对AD与哮喘的两项2b期临床研究。
ISB 2001:公布1期临床试验的新数据
Ichnos Glenmark Innovation公司公布了其三特异性抗体ISB 2001用于治疗复发/难治性多发性骨髓瘤(RRMM)的1期研究的新数据。ISB 2001同时靶向多发性骨髓瘤(MM)细胞上的BCMA和CD38,以及T细胞上的CD3,旨在增加对MM细胞的特异性结合,同时最大限度地减少脱靶效应。
此次公布的结果显示,在经过大量治疗的患者群体中,7个活性剂量(≥50 μg/kg)组患者的持续总缓解率为79%,完全缓解/严格完全缓解(CR/sCR)率为30%。所有接受治疗的患者的总缓解率为74%,包括2例接受较低剂量治疗的患者。安全性方面,ISB 2001具有良好的安全性,大多数患者在数据截止时仍在接受治疗。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..