本期看点
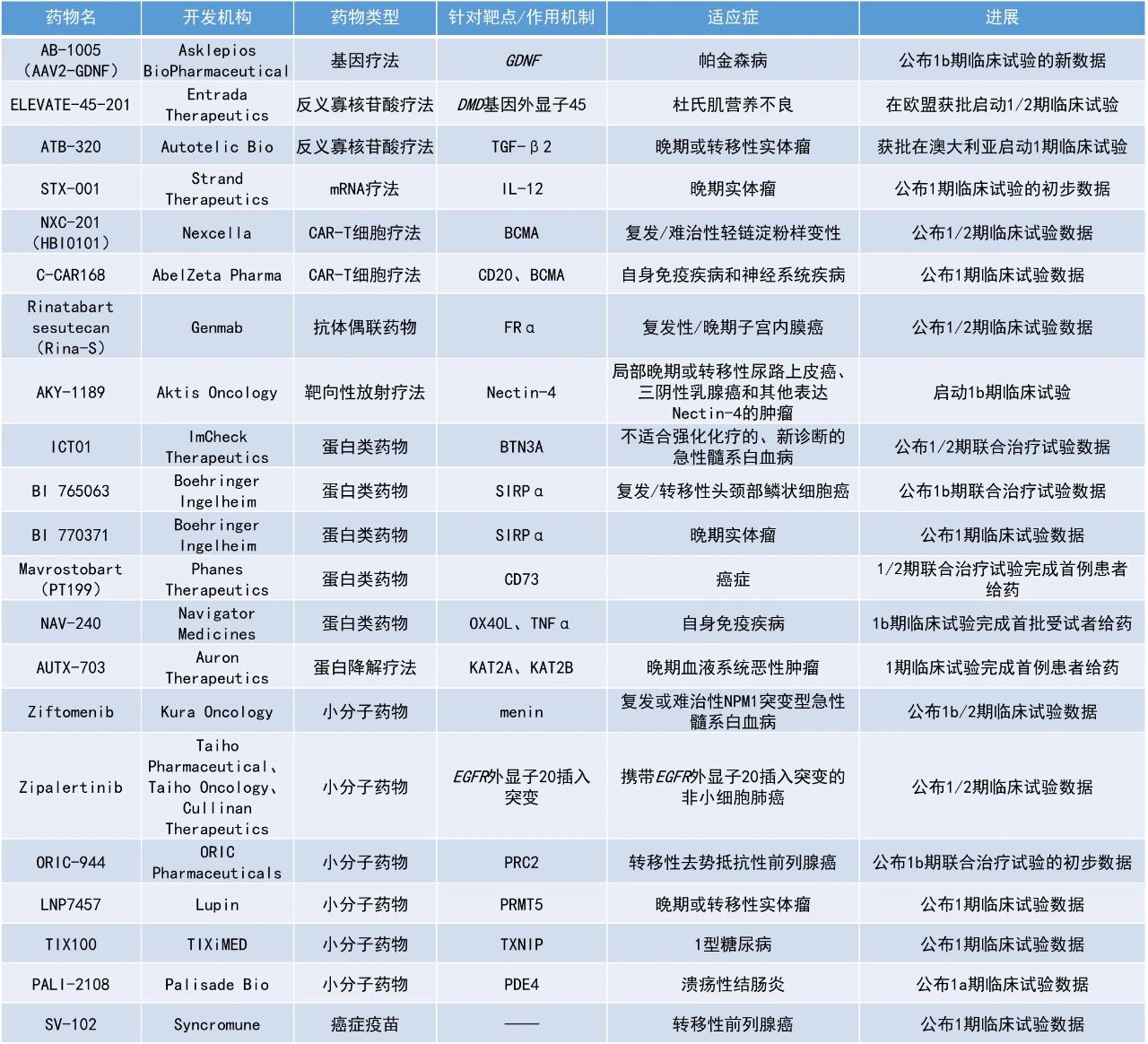
Rinatabart sesutecan:公布1/2期临床试验数据
Genmab公司日前披露旗下的候选疗法rinatabart sesutecan(Rina-S)在1/2期试验中,用以治疗复发性/晚期子宫内膜癌患者中的疗效结果。Rina-S是一种潜在“best-in-class”、叶酸受体α(FRα)靶向ADC,Genmab在去年4月收购普方生物(ProfoundBio)时获得此款疗法。
截至2024年11月22日,64例接受过大量既往治疗的子宫内膜癌患者(中位3线,范围1-8)接受了100 mg/m2(n=22)或120 mg/m2(n=42)剂量的Rina-S治疗。在疗效可评估患者中,中位治疗持续时间为18.7周。分析显示,接受低(n=22)与高(n=33)剂量患者的未确认ORR分别为50%与45.5%,其中低剂量组包含2例CR。低与高剂量组患者的DCR则分别为100%和81.8%。此外,在低与高剂量组中,分别有81.8%(9/11)与80.0%(12/15)患者持续缓解。安全性方面,最常见(>25%)的治疗伴发不良事件(TEAE)在不同剂量下相似,主要是血细胞减少症和1-2级胃肠道事件(恶心、呕吐、食欲下降)。
ICT01:公布1/2期联合治疗试验数据
ImCheck Therapeutics公司公布了其新型γ9δ2 T细胞激活剂ICT01联用Aza-Ven治疗不适合强化化疗的新确诊AML患者的积极1/2期临床试验数据。γ9δ2 T细胞是先天免疫系统的一部分,负责对肿瘤和感染的免疫监察。ICT01是一款靶向嗜乳脂蛋白家族成员BTN3A的单克隆抗体疗法,通过与BTN3A结合,它可以选择性地激活γ9δ2 T细胞,并且促进它们迁移和浸润肿瘤,进一步激发CD8阳性T细胞和自然杀伤细胞的抗肿瘤反应。
截至2025年1月20日的数据,接受推荐剂量的ICT01联合治疗的患者的CRc率为96%,CR率为74%,且各种分子亚型的患者均有缓解。值得注意的是,具有不良或中等风险突变的患者通常对Aza-Ven治疗应答较低,但接受三联疗法治疗的患者实现了高缓解率,例如TP53突变AML患者的CR和CRc率分别达到了60%和83%。此外,接受10 mg ICT01治疗的患者初步的9个月总生存率为83%。安全性方面,三联疗法在临床上具有良好的可控性。
SV-102:公布1期临床试验数据
Syncromune公司公布了其个体化癌症疫苗SV-102在mCRPC患者中的1期临床试验结果。数据表明,接受SV-102治疗患者的ORR为87%,53%的患者达到了CR。安全性方面,SV-102耐受性良好,观察到的TEAE多为低级别。
ORIC-944:公布1b期联合治疗试验的初步数据
ORIC Pharmaceuticals公司公布了其选择性PRC2别构抑制剂ORIC-944联用雄激素受体(AR)抑制剂治疗mCRPC的1b期临床试验的初步数据。截至2025年5月9日的数据,59%(10/17)的患者达到PSA50应答(即前列腺特异性抗原水平降低50%),确认的PSA50应答率为47%(1例待确认),24%(4/17)的患者达到确认的PSA90应答。在所有ORIC-944剂量水平中均观察到PSA应答,目前大多数患者仍在继续治疗,其中多名患者的治疗时间已接近一年或更长。安全性方面,ORIC-944与apalutamide或darolutamide联合使用的耐受性普遍良好,绝大多数不良事件为1/2级,与PRC2和AR抑制一致。
STX-001:公布1期临床试验的初步数据
Strand Therapeutics公司公布了其自我复制mRNA疗法STX-001用于治疗晚期实体瘤的1期临床试验结果。STX-001是一种脂质纳米颗粒封装的自我复制mRNA药物,可激活先天免疫系统,促进免疫原性癌细胞死亡,并表达IL-12以诱导针对肿瘤的免疫反应。在临床前模型中,STX-001表现出显著的免疫调节和抗肿瘤活性。
从2024年5月29日至数据截止日期(2024年12月16日),5名完成评估的黑色素瘤患者中,有3人的非注射病灶缩小(即远隔效应),其中1例达到确认的CR,1例达到部分缓解(PR),1例靶病灶缩小100%,多个皮肤/内脏病灶出现显著的炎症反应。STX-001显示出初步良好的疗效、强烈的免疫激活作用以及可控的安全性。这些结果支持其作为单药疗法以及与免疫检查点抑制剂联合使用的进一步开发。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..