5月23日,中国国家药监局药品审评中心(CDE)官网最新公示,信达生物1类新药IBI363拟纳入突破性治疗品种,适应症为经含铂化疗及抗PD-1/PD-L1免疫治疗失败的局部晚期或转移性鳞状非小细胞肺癌。IBI363是信达生物在研的一款PD-1/IL-2α-bias双特异性抗体融合蛋白。针对本次拟纳入突破性治疗品种的适应症,IBI363此前已经被美国FDA授予快速通道资格。
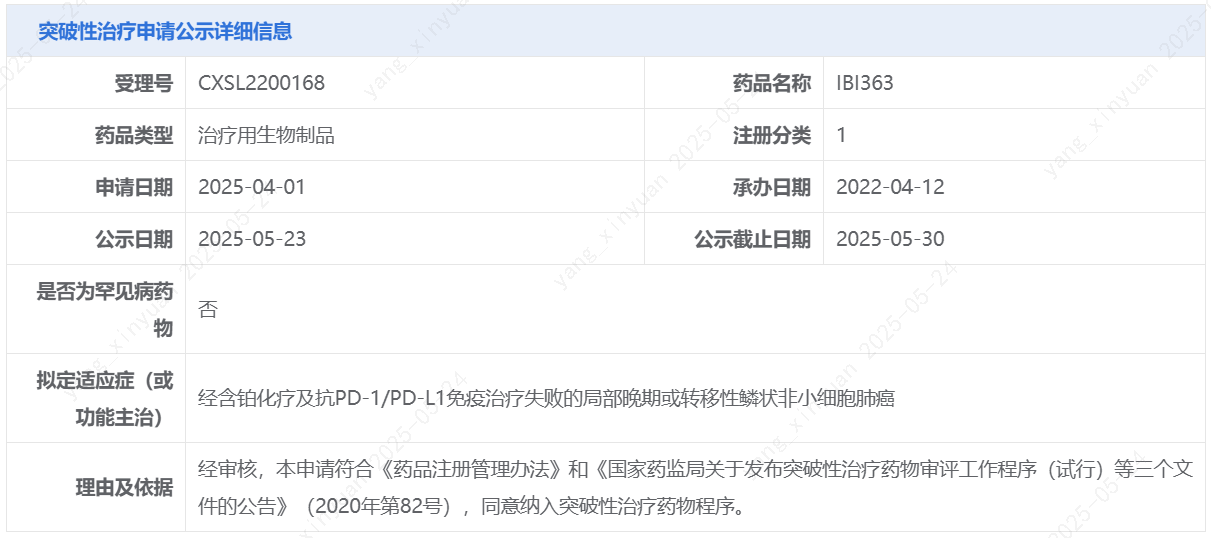
截图来源:CDE官网
IBI363是由信达生物自主研发的PD-1/IL-2α-bias双特异性抗体融合蛋白,同时具有阻断PD-1/PD-L1通路和激活IL-2通路两项功能。IBI363的IL-2臂经过了设计改造,保留了其对IL-2 Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性;而PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。由于新激活的肿瘤特异性T细胞同时表达PD-1和IL-2α,这一差异性策略可以更精确和有效地实现对该T细胞亚群的靶向和激活。IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。
今年2月,信达生物宣布IBI363获得FDA授予快速通道资格,拟定适应症为抗PD-(L)1免疫检查点抑制剂及含铂化疗治疗后进展的局部晚期或转移性鳞状非小细胞肺癌。这也正是本次拟纳入突破性治疗品种的适应症。
根据信达生物此前新闻稿,在2024年9月的世界肺癌大会(WCLC)上,IBI363报道了在既往接受过免疫治疗的鳞状非小细胞肺癌受试者中观察到令人欣喜的疗效信号:
在3mg/kg剂量组至少随访12周以上或已结束研究的患者中(n=18),ORR(客观缓解率)为50.0%,DCR(疾病控制率)为88.9%。中位PFS(无进展生存期)未达到,仍在随访中。
而在1/1.5 mg/kg剂量组中,中位PFS达5.5个月,12个月PFS率为30.7%,显示出免疫治疗的长期获益优势;
在1/1.5/3 mg/kg剂量组中,PD-L1 TPS<1%(n=22)的受试者和TPS≥1% (n=22)的受试者ORR分别为36.4%和31.8%,提示IBI363在PD-L1低表达人群中的潜在优势。
研究人员认为,无论PD-L1表达水平如何,IBI363均展现了强大的抗肿瘤作用,提示IBI363作用不依赖于PD-L1表达,预示IBI363不仅在免疫治疗失败人群中,在PD-L1低表达甚至不表达的冷肿瘤中,也可能带来突破性的进展。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..