5月8日,欧洲药品管理局(EMA)GMP/GDP检查工作组发布了“关于修订第四部分先进疗法产品GMP指南的概念性文件”,文件指出,ATMP指南修订将与2023年8月生效的无菌附录保持一致,同时保持ATMP生产的灵活方法。该文件征求意见的截止时间是2025年7月8日。
指南更新将涵盖哪些变化
欧盟的ATMP GMP指南发布于2017年11月,那时欧盟无菌附录仍在修订中,后于2022年8月最终定稿,因此无菌附录修订的相关概念和要求均未体现在ATMP指南中,如质量风险管理(QRM)、药品质量体系(PQS)、污染控制策略(CCS)等。
ATMP指南将澄清以下内容:
新技术进步:将进一步澄清洁净室及密闭系统(隔离器和RABS)的确认、控制和管理要求,同时考虑到个性化批次有大量手动操作,指南对使用生物安全柜仍持开放态度;指南将包括当前指南未涵盖的新技术,如自动化先进技术、(密闭)一次性使用技术、快速微生物检测方法等;
人源起始物料的定义:2024年7月17日,欧盟更新了关于拟用于人体的人源物质的质量和安全标准的法规(Regulation 2024/1938),本次修订将更新人源起始物料参考的法规依据和定义;
指南修订将仅关注和无菌附录相关的无菌生产章节,而不会更新该范围外的主题/章节。
指南修订时间表
指南修订后续的时间安排如下:
2025年5月 – 概念性文件公开征求意见
2025年7月 – 征求意见截止
2026年9月 – 发布指南修订草案
2026年12月 – 征求意见截止
2027年3月 – GMDP工作组采纳
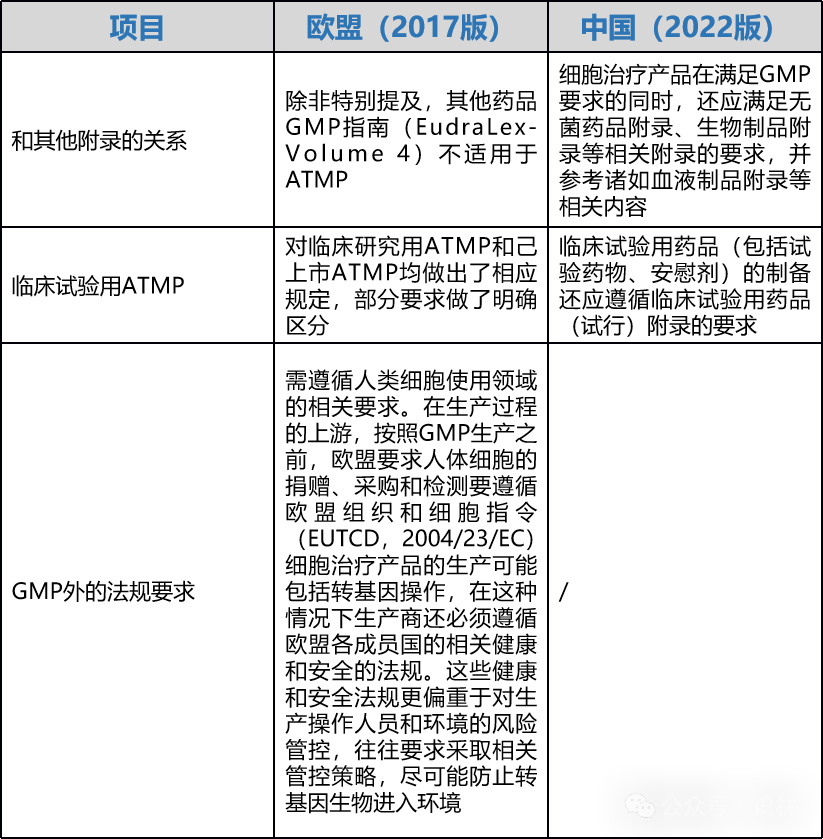
指南当前版本和中国指南应用的差异
我国于2019年11月首次发布了《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》,在2022年1月再次更新征求意见,并最终由CFDI于2022年10月发布《细胞治疗产品生产质量管理指南(试行)》。二者均为针对细胞治疗产品等先进疗法产品的指南,以下差异值得关注:
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..