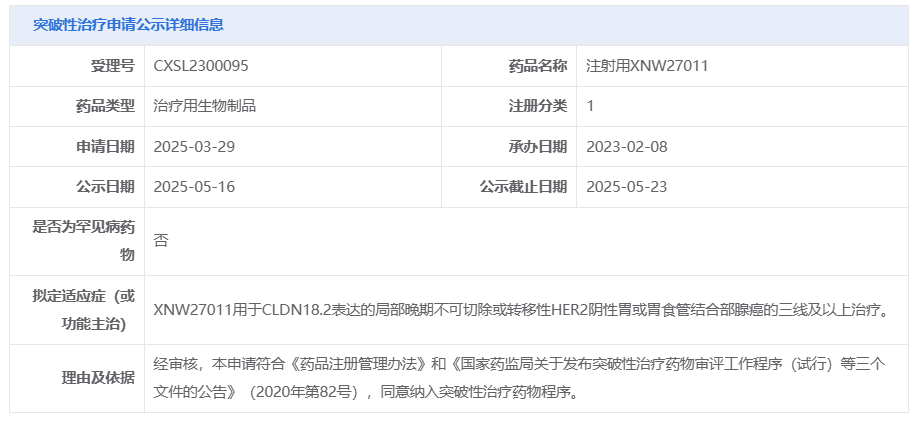
5 月 16 日,CDE 官网显示,信诺维 1 类新药注射用 XNW27011 拟纳入突破性治疗品种,适应症为:用于 CLDN18.2 表达的局部晚期不可切除或转移性 HER2 阴性胃或胃食管结合部腺癌的三线及以上治疗。
Claudin18.2 是一类存在于上皮和内皮紧密连接中的整合素膜蛋白,是紧密连接的重要组成部分。Claudin18.2 特异地表达在分化的胃黏膜上皮细胞,但在胃癌,胰腺导管腺癌、食管癌、卵巢癌、肺癌、结肠癌和胆道癌等多个癌肿异常表达,其在胃癌、胰腺癌中表达率达到 50% 以上。这一特点使 Claudin18.2 成为实体瘤免疫疗法的一个理想靶点。
XNW27011 是信诺维开发的新一代抗体偶联药物(ADC),靶向 Claudin18.2。2024 年 6 月,XNW27011 获得 FDA 授予快速通道资格,用于治疗胃癌。
2024 年 ESMO 大会上,信诺维公布了 XNW27011 针对局部晚期和/或转移性实体瘤患者的 首次人体 I 期临床研究结果。在该研究中,XNW27011 剂量从 0.6 mg/kg(每三周一次,静脉注射)开始,采用加速剂量递增方案,随后进行 3+3 递增。剂量递增阶段的主要目标是确定最大耐受剂量 (MTD)。
截至 2024 年 4 月 15 日,共入组 16 例患者,剂量范围从 0.6 mg/kg 至 6.0 mg/kg,分为 6 个剂量组,包括 11 例胃癌/胃食管交界处腺癌、2 例卵巢癌、2 例前列腺癌和 1 例十二指肠壶腹部周围腺癌。12 例患者存在不同程度的 CLDN18.2 表达(≥1%,IHC≥1+)。
在剂量限制性内镜(DLT)治疗期间,最常见的不良反应(AE)为恶心和呕吐,其次是白细胞减少、中性粒细胞减少和贫血。在剂量限制性内镜治疗期间,4.8 mg/kg 剂量以下未观察到≥3 级 TRAE。未观察到 ILD 或 MMAE 相关的眼部不良反应和周围神经病变。1 例患者在 6.0 mg/kg 剂量下出现 DLT。
14 例患者可评估疗效,具体数据如下表。即使剂量低至 0.6 mg/kg,也观察到疗效。先前接受过 PD-1 免疫疗法、伊立替康或 CLDN18.2 抗体治疗的患者似乎未对疗效产生影响。
综上,研究认为,XNW27011 表现出良好的安全性,具有较大的治疗窗口,在各种肿瘤类型和 CLDN 18.2 表达水平下均具有优异的初步疗效,并且具有优异的药代动力学特性,包括低有效载荷血浆暴露。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..