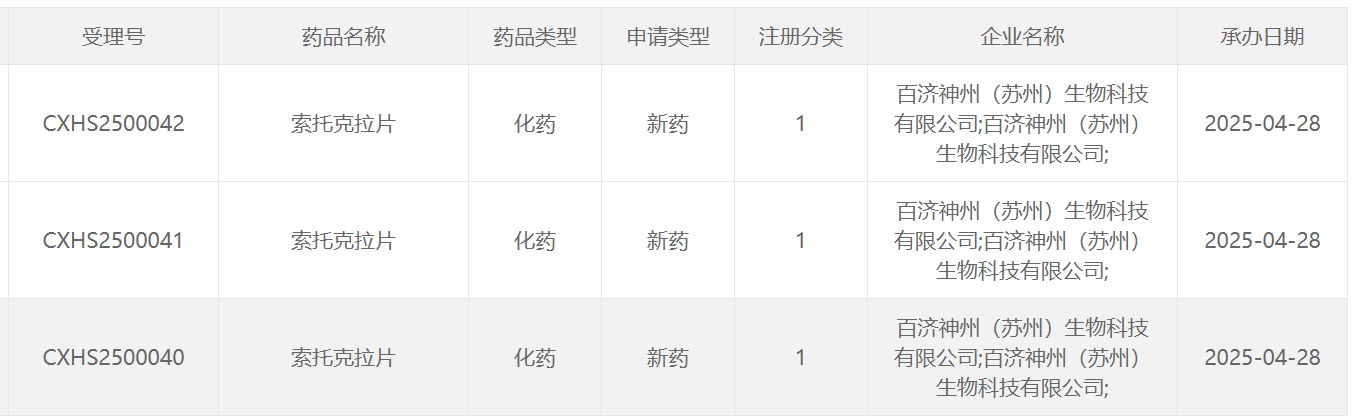
4月29日,中国国家药监局药品审评中心(CDE)官网最新公示,百济神州申报的索托克拉片的上市申请获得受理。该上市申请已经被CDE正式纳入优先审评,适用于治疗既往接受过治疗的慢性淋巴细胞白血病(CLL)/ 小淋巴细胞淋巴瘤(SLL)成人患者。公开资料显示,索托克拉片(sonrotoclax)是百济神州在研的新一代BCL2抑制剂。
据百济神州公开资料介绍,sonrotoclax是一种强效且具有特异性的BCL2抑制剂,旨在阻断可帮助肿瘤细胞存活的BCL2蛋白。sonrotoclax在多种B细胞恶性肿瘤中表现出良好的临床活性,迄今为止共有超过1800例患者入组了该药物全球研发计划。美国FDA还已经授予该产品快速通道资格,用于治疗套细胞淋巴瘤(MCL)和华氏巨球蛋白血症(WM)患者。该产品治疗既往接受过抗CD20治疗和BTKi治疗的套细胞淋巴瘤(MCL)成人患者也已经被CDE纳入优先审评。
在2024年欧洲血液学协会(EHA)年会上,百济神州展示了sonrotoclax的两项1期研究数据,包括:
sonrotoclax联合泽布替尼用于R/R CLL/SLL患者的1期研究,结果显示出深度和持久的缓解。具体而言,在所有剂量水平的32例可评估反应的患者中,ORR为97% (31/32;1例患者出现SD),完全缓解(CR)率为50% 。达到CR的中位时间为9.8个月。在4例既往接受BTKi治疗的可评估疗效的患者中,3例达到PR (n=2)或CR (n=1)。所有接受sonrotoclax+泽布替尼治疗的患者(100%)在第48周达到了uMRD4。
sonrotoclax联合泽布替尼用于治疗R/R MCL患者的1a/1b期、开放性、剂量递增和扩展研究,研究显示该联合用药方案总体耐受性良好,并展现出具有前景的有效性(包括较高的深度和持久缓解率)。在27例反应可评估的患者中,ORR为85%,其中包括18例CR(67%)。对于剂量扩大队列中可评估反应的患者,320mg队列的CR率和ORR分别为91%和91%,160mg队列的CR率和ORR分别为44%和88%。达到CR的中位时间为6.4个月。在2例既往有BTK抑制剂进展的可评估疗效的患者中,观察到1例CR和1例PD。
根据百济神州今日发布的2024年度报告披露,sonrotoclax的首项3期随机试验CELESTIAL-TN CLL针对TN-CLL适应症,旨在比较sonrotoclax联合百悦泽(泽布替尼)与维奈克拉联合奥妥珠单抗的疗效,已于2025年第一季度完成入组。另外一项用于支持TN-CLL适应症注册的2期研究也已开始入组,该研究旨在比较sonrotoclax 联合百悦泽与百悦泽单药的疗效,以评估各药物在治疗中的贡献。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..