4月28日,中国国家药监局药品审评中心(CDE)官网最新公示,诺华(Novartis)申报的镥[177Lu] 特昔维匹肽注射液一项新适应症上市申请获得受理。公开资料显示,这是诺华研发的靶向PSMA的放射配体疗法(RLT)Pluvicto(lutetium Lu 177 vipivotide tetraxetan) 。该药此前已经在中国申报首个适应症上市申请,并被CDE纳入优先审评,用于治疗PSMA阳性转移性去势抵抗性前列腺癌(mCRPC) 、已接受雄激素受体通路抑制和紫杉类化疗的成年患者。
根据诺华公开资料可以推测,本次该药申报上市的适应症为:用于更早线未经化疗的PSMA阳性的mCRPC患者。针对该项适应症,Pluvicto于今年4月获得了美国FDA批准。
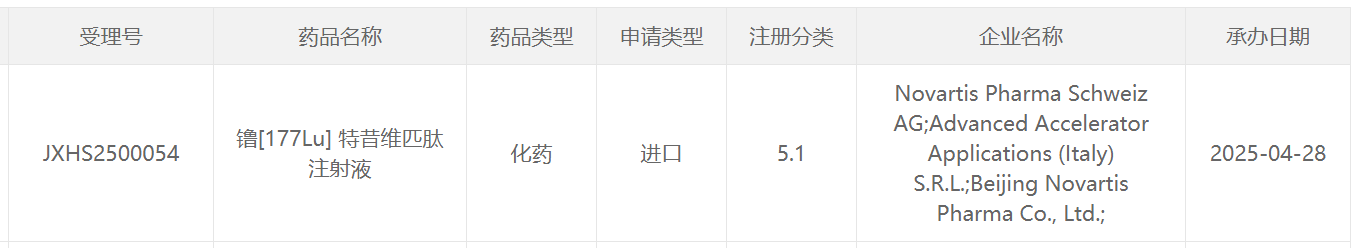
截图来源:CDE官网
Pluvicto是通过静脉注射的放射配体疗法(RLT),由靶向配体与治疗性放射性核素(镥-177)结合而成。进入血液后,Pluvicto可靶向结合表达PSMA的前列腺癌细胞。结合后,放射性同位素释放的能量可破坏靶细胞,抑制其复制能力和/或引发肿瘤细胞死亡。
2025年4月,诺华宣布FDA批准Pluvicto用于接受过一种雄激素受体通路抑制剂(ARPI)治疗且被认为适合延迟化疗的PSMA阳性的mCRPC患者。此适应症获批是基于3期PSMAfore临床研究的结果,将符合Pluvicto治疗条件的患者人群扩大约三倍。
研究结果显示,与更换ARPI方案相比,Pluvicto将PSMA阳性mCRPC患者的影像学进展或死亡风险降低59%。在更新的探索性分析中,Pluvicto组的中位影像学无进展生存期延长了一倍以上(11.6个月 vs. 5.6个月)。
PSMAfore研究的其他结果显示,Pluvicto表现出一致的、更好的安全性特征。最常见的所有级别的不良事件主要为1-2级,包括口干(61%)、疲劳(53%)、恶心(32%)和便秘(22%)。Pluvicto不影响患者后续接受化疗的能力。
根据诺华此前新闻稿介绍,除了已获批的适应症,诺华正在探索Pluvicto在疾病更早期阶段的应用,包括转移性激素敏感性前列腺癌(mHSPC,PSMAddition研究)和寡转移性前列腺癌(PSMA-DC)。其中,PSMAddition研究被《自然》子刊Nature Medicine评为了2025年潜在影响医学发展的关键临床试验。Nature Medicine表示,如果Pluvicto获得FDA批准用于治疗mHSPC患者,这将成为一个重大突破,有潜力改变全球数十万前列腺癌患者的治疗格局。
诺华还正在开发广泛的RLT产品组合,探索新同位素、配体及联合疗法,以拓展适应症至胃肠胰神经内分泌肿瘤(GEP-NETs)和前列腺癌之外的乳腺癌、结肠癌、肺癌及胰腺癌。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..