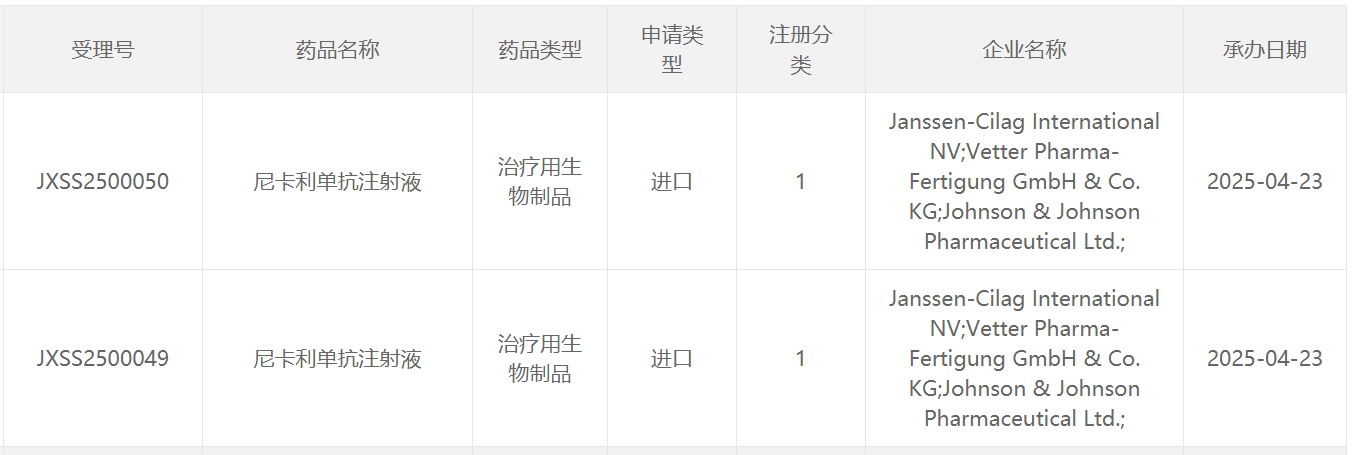
4月23日,中国国家药监局药品审评中心(CDE)官网最新公示,强生公司(Johnson & Johnson)申报的1类新药尼卡利单抗注射液的上市申请已获得受理。公开资料显示,尼卡利单抗(nipocalimab)是一款靶向新生儿Fc受体(FcRn)的抗体疗法。该产品已向美国FDA申报上市,用于治疗全身性重症肌无力(gMG),PDUFA日期为4月29日。值得一提的是,这款疗法还于今年年初被行业媒体Evaluate列为今年有望上市的10大潜在重磅疗法之一。 在中国,该产品已经于去年10月被CDE正式纳入优先审评,适用于治疗自身抗体阳性(抗乙酰胆碱受体[AChR]阳性、抗肌肉特异性酪氨酸激酶[MuSK]阳性或抗低密度脂蛋白受体4 [LRP4]阳性)的全身型重症肌无力(gMG)成人患者和青少年患者(大于12岁)。尼卡利单抗是一款靶向新生儿Fc受体的抗体疗法。该产品通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会重新释放到血液中,而是在细胞内被降解。已有研究显示,它可以将血液循环中包括致病自身抗体在内的IgG水平降低超过75%。致病性IgG被认为是自身抗体疾病的根本原因之一。此前,强生公司已先后向FDA和欧洲药品管理局(EMA)提交了尼卡利单抗的上市许可申请,寻求全身型重症肌无力(gMG)的适应症批准。尼卡利单抗此前也已经被CDE纳入突破性治疗品种,以及被FDA授予优先审评资格,治疗gMG。此外,nipocalimab还因其在治疗中重度干燥综合征的2期临床试验DAHLIAS的结果,被FDA授予突破性疗法认定。
2025年1月,强生宣布《柳叶刀》子刊The Lancet Neurology已发表其关键性3期临床试验Vivacity-MG3的结果。这项研究评估了在研疗法尼卡利单抗在广泛的抗体阳性(抗AChR、抗MuSK和抗LRP4)的全身性重症肌无力(gMG)成年患者中的疗效。研究达到主要终点,在24周内,接受尼卡利单抗治疗患者的gMG疾病指标日常生活活动评分(MG-ADL)获得统计学显著和具有临床意义的改善。
具体而言,3期研究数据显示,从基线开始,尼卡利单抗可使总IgG的中位水平降低最多达75%。此外,研究还观察到常见的致病性IgG(如抗AChR抗体和抗MuSK抗体)水平在24周内显著下降。研究未观察到总IgE、IgA和IgM的变化,这表明即使在致病性IgG自身抗体水平下降后,保护性免疫系统仍可能保持正常功能。
尼卡利单抗联合标准治疗(SOC)在MG-ADL应答(与基线相比≥2分的改善)方面显著优于安慰剂联合SOC。对于gMG患者而言,与基线相比1到2分的MG-ADL变化可能意味着从正常进食到频繁吞咽困难,或从静息时呼吸短促到需要借助呼吸机的重大差异。重症肌无力是一种自身抗体阻断神经突触信号传递的罕见病,由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起,约85%的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG)。对于重症肌无力,临床存在极大未被满足的临床需求。期待强生这款突破性抗体疗法早日获批上市,造福更多患者。