5月12日,亚虹医药宣布,中国国家药监局药品审评中心(CDE)已受理非手术治疗产品APL-1702(通用名:盐酸氨酮戊酸己酯软膏光动力治疗系统)的新药上市申请(NDA),拟用于治疗18岁及以上排除原位癌的经组织学证实的宫颈高级别鳞状上皮内病变(HSIL)患者。根据亚虹医药公开资料,APL-1702是集药物和器械为一体的光动力治疗产品。
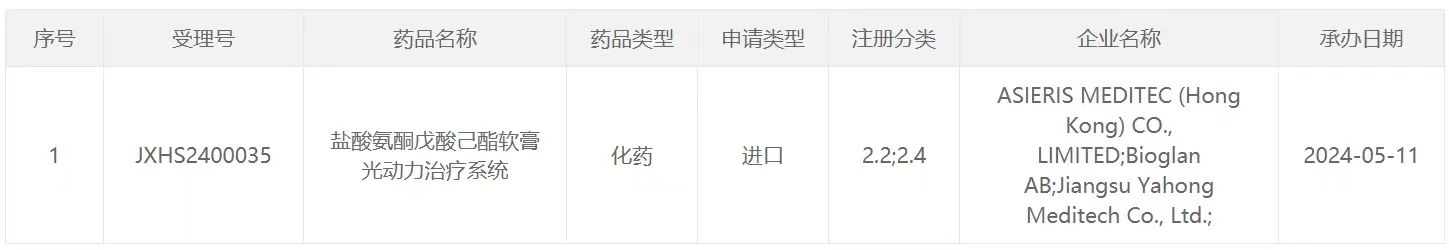
截图来源:CDE官网
宫颈癌的主要诱因是HPV病毒持续感染导致的宫颈癌前病变,其中约20%的HSIL人群可能在10年内进展为浸润性宫颈癌。宫颈HSIL患者传统治疗方式为局部手术,手术易产生宫颈出血、感染、宫颈功能不全等不良反应。宫颈功能不全会引起早产、流产、剖宫产率增加等一系列生育问题。在宫颈癌前病变的治疗领域,目前还缺乏经3期临床试验确证有临床疗效的非手术类产品获批上市。
作为一款光动力治疗在研产品,APL-1702的活性成分为5-氨基酮戊酸己酯(HAL),其治疗原理为基于靶细胞中蓄积的光敏剂在光照下产生大量活性氧,进而诱导病变细胞凋亡、坏死。
根据亚虹医药新闻稿介绍,APL-1702已经随机、双盲、对照的国际多中心3期临床研究验证的,疗效确切。该产品的获批有望改善宫颈癌前病变的治疗目标,使临床治疗从此前的关注切除手术的一次性治疗效果,转变到聚焦疾病的长期管理,重点在于优化治疗的获益-风险比,在逆转疾病的前提下尽可能避免和推迟损伤性的外科手术治疗。
亚虹医药首席开发官吴虹博士表示,即便经过手术治疗,HSIL仍有病变持续存在甚至复发的风险,且后续发生宫颈癌的风险仍高于普通女性(10年内发生浸润癌风险是普通女性的5倍),手术治疗后仍要持续随访至少25年。因此,保留完整宫颈、避免或延缓宫颈创伤的非手术疗法,对于宫颈癌前病变患者的长期管理有重大意义。CDE对APL-1702上市申请的受理,意味着他们向为患者提供新治疗选择的目标又迈进了一步。
参考资料:
[1] 全球首个非手术治疗宫颈高级别鳞状上皮内病变产品APL-1702新药上市申请获NMPA受理. Retrieved May 12,2024, From https://mp.weixin.qq.com/s/lRJzQT_jvdXYycdQLIWicw
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..