3 月 16 日,据 CDE 官网显示,第一三共递交的 Dato-DXd 上市申请获受理,用于治疗既往在不可切除或转移性疾病阶段接受过系统治疗的 HR 阳性、HER2 阴性(IHC 0、IHC 1+ 或 IHC 2+/ISH-)的不可切除或转移性乳腺癌成人患者。
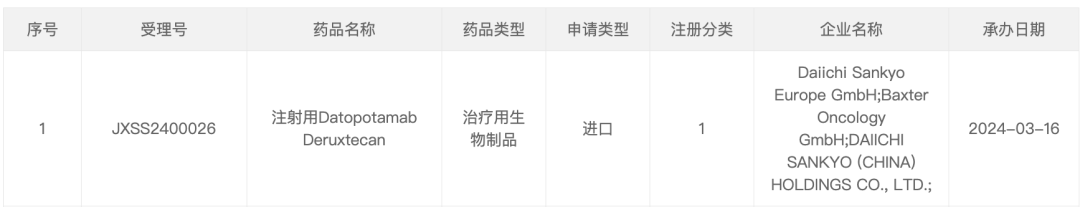
来自:CDE 官网
Dato-DXd (Datopotamab deruxtecan/德达博妥单抗)是第一三共和阿斯利康共同开发的 TROP2 ADC。
此次德达博妥单抗的上市许可申请递交是基于关键性 III 期临床 TROPION-Breast 01 研究的数据。
TROPION-Breast01 研究是 Dato-DXd 首个公布结果的乳腺癌 III 期临床试验,旨在评估 Dato-DXd 对比研究者选择的化疗方案在既往接受过内分泌治疗和至少一种全身治疗的不可切除或转移性 HR 阳性、HER2 低表达或阴性(IHC 0、IHC 1+ 或 IHC 2+/ISH-)乳腺癌中的疗效和安全性。主要终点为经 BICR 评估的 PFS 和 OS。
在 2023 ESMO 大会上公布的该研究结果显示,在主要终点 PFS 方面,经 BICR 评估,与研究者所选化疗(ICC)相比,Dato-DXd 用于内分泌经治的 HR 阳性、HER2 阴性(IHC0,IHC1+或 IHC2+/IHC-)转移性乳腺癌患者,可将疾病进展或死亡风险显著降低 37%(HR = 0.63;95% CI: 0.52-0.76;p<0.0001)。
Dato-DXd 治疗组的中位 PFS 为 6.9 个月,而化疗组 为 4.9 个月。在不同的亚组中均观察到一致的 PFS 获益。此外,Dato-DXd 组的 ORR 为 36.4%,而化疗组为 22.9%。
在针对研究另一双主要终点 OS 的期中分析中,截至数据截止日期,Dato-DXd 也显示出优于化疗 OS 改善趋势(HR = 0.84;95% CI: 0.62-1.14)。研究目前正在进行中,将对 OS 进行进一步评估。
安全性方面,Dato-DXd 整体安全性良好,未发现新的安全性问题。Dato-DXd 治疗组和化疗组 3 级或以上治疗相关不良事件(TRAE)发生率分别为 21% 和 45%,Dato-DXd 组不到化疗组的一半。
在乳腺癌领域,据 Insight 数据库显示,第一三共/阿斯利康共开展了 5 项 III 期临床试验,除针对 HR+/HER2- 乳腺癌外,还包括转移性三阴性乳腺癌一线疗法以及辅助疗法等。
在乳腺癌之外,同时也在推进在肺癌领域的进展。上个月,两家公司联合宣布,Dato-DXd BLA 申请已获 FDA 受理,用于既往接受过全身治疗的局部晚期或转移性非鳞状 NSCLC 成年患者。PDUFA 日期为 2024 年 12 月 20 日。有望成为全球首个治疗肺癌的 TROP ADC。
此外,也在探索 Dato-DXd 与免疫检查点抑制剂联用的疗效。当前,第一三共/阿斯利康和默沙东正在合作开展 TROPION-Lung02、TROPION-Lung07 和 TROPION-Lung08 3 项临床研究,旨在评价 Dato-DXd 和 K 药的联合疗法。
其中,联合开展的 Ib 期临床 TROPION-Lung02 研究是首个评价 TROP2 ADC 和免疫检查点抑制剂联合治疗晚期 NSCLC 患者(伴或不伴铂类化疗)的研究。2023 ASCO 大会上公布的 TROPION-Lung02 研究的最新结果显示,Dato-DXd 联合 K 药(伴或不伴铂类化疗)在既往未经治疗的患者中 ORR 分别为 57% 和 50%,各队列间的疾病控制率达 91%。
而对于胃癌、子宫内膜癌等其他癌种,也在 2022 年 7 月启动了一项 II 期全球临床研究(登记号:NCT05489211),同年 9 月已完成全球首例受试者的入组工作,预计主要指标于 2025 年 3 月完成。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..