近日,石药在2024年ASCO泌尿生殖系统肿瘤研讨会(ASCO-GU2024)上,公布了靶向nectin-4抗体药物偶联物(ADC)SYS6002的I期剂量递增数据。
2023年2月,石药集团附属公司石药巨石生物与Corbus Pharmaceuticals(简称“Corbus”)就SYS6002 (CRB-701)的开发及商业化订立独家授权协议。根据协议条款:石药巨石生物同意授予Corbus在美国、英国、加拿大、澳大利亚等一些国家在该地区开发及商业化该产品的独家授权,石药巨石生物将收取7,500,000美元的首付款,并有权收取最多130,000,000美元的潜在开发及监管里程碑付款、以及最多555,000,000美元的潜在销售里程碑付款。总交易金额高达6.925亿美元。
关于I期试验
I期SYS6002-011试验旨在评估SYS6002在6个剂量组(0.2、0.6、1.2、1.8、2.7和3.6 mg/kg)的安全性和耐受性,以确定对标准治疗失败或不耐受的晚期实体瘤患者的最大耐受剂量(MTD)和/或II期剂量。除了确定安全性和耐受性外,还对SYS6002 (CRB-701)的药代动力学(PK)和初步抗肿瘤活性进行了评估。
迄今为止,入组的患者年龄在37-76岁之间,其中69%的患者为女性,适应症涵盖转移性尿路上皮癌(mUC)、宫颈癌、三阴性乳腺癌(TNBC)和结直肠癌(CRC),经过多线治疗失败(治疗中位数为4线)。结果显示:
所有6个剂量组均入组,0.2-2.7 mg/kg组无剂量限制性毒性(DLT)进展,患者最长随访时间为10个月。
SYS6002耐受性良好,大多数不良事件严重程度为1/2级。1/2级治疗相关不良事件发生率>20%包括角膜上皮病变、血液病、高甘油三酯血症、低钠血症、蛋白尿、贫血和干眼。值得注意的是,皮疹和周围神经病变的发生率均为0%。
在剂量递增队列中,SYS6002 (CRB-701) 的药代动力学(PK)参数与剂量成正比;相对于相似剂量水平下的Enfortumab vedotin(EV),SYS6002具有更长的ADC半衰期和更低的游离MMAE。
确定了多种剂量的抗肿瘤反应:在0.6mg/kg时疾病稳定;在1.2 mg/kg时发生部分反应,即病变直径总和减少了60%。
公司计划继续开发SYS6002 (CRB-701)作为单药和联合治疗。
关于SYS6002
SYS6002 是公司研发的重组人源化抗Nectin-4 ADC,采用公司专有的酶催化定点抗体偶联技术。该ADC 产品的连接子稳定性更高、具有更好的安全性和疗效潜能,可与肿瘤表面的特异性受体结合,通过内吞作用进入细胞,释放毒素,达到杀伤肿瘤细胞的作用。2022年10月,SYS6002获CDE批准临床。临床前研究显示,该产品对多种癌症均显示较好的抗肿瘤作用。
Nectin-4 可以促进肿瘤增生、血管生成、淋巴管生成以及淋巴转移,在包括膀胱癌、三阴性乳腺癌、肺癌、结直肠癌、胰腺癌、卵巢癌等多个癌种中高表达,而在健康人体组织中低表达,阻断Nectin-4 的表达可减少肿瘤增殖。
据不完全统计,目前在研的Nectin-4 ADC约二十余种,仅有一款nectin-4 ADC 产品上市, 是来自安斯泰来的Enfortumab vedotin(Padcev),于2019 年被FDA 获批用于治疗局部晚期和转移性尿路上皮癌。
关于石药在ADC的管线布局
据不完全统计,目前石药在ADC领域共布局超11款药物,靶点涉及HER2、EGFR、nectin-4、CLDN18.2、HER3、ROR1、TROP2等。
除SYS6002外,重点临床阶段药物还包括:
DP303c:是一种新型位点特异性酶法偶联抗HER2抗体-MMAE衍生物偶联的ADC药物,DAR为2.0。临床前研究表明,在异种移植模型中,DP303c的抗肿瘤活性与T-DM1相似甚至更强。该药物是石药集团进展最快的ADC,获得FDA孤儿药认证。
I期临床显示,在治疗HER2表达的晚期实体瘤中,采用0.5、1.0、2.0、3.0和4.0mg/kg时剂量递增,然后在3.0mg/kg时进行剂量扩展,每3周静脉给药一次。主要终点是安全性和RP2D。结果显示:(1)在91名疗效可评估的患者中,ORR为42.9%(95%CI:32.5-53.7),DCR为68.1%(95%CI:57.5-77.5)。中位 PFS 为4.44个月(95%CI:3.35-6.44),DoR为10.97个月(95%CI:3.98-NA)。(2)在66例可进行疗效评估的乳腺癌患者中,ORR和DCR分别为51.5%(95%CI:38.9-64.0)和77.3%(95%CI:65.3-86.7)。中位PFS和DoR分别为6.44个月(95%CI:4.14-8.51)和10.97个月(95%CI:3.98-NA)。(3)4.0mg/kg的剂量出现了一次剂量限制性毒性[3级眼痛],3.0mg/kg被选为扩展剂量。所有94名患者均发生了任何等级的治疗相关不良事件(TRAEs),其中34例(36.2%)为G 3级。最常见的 G 3 不良事件是视力模糊(16.0%)、眼球干涩(6.4%)和周围神经病变(3.2%)。没有发生与治疗相关的死亡病例。
CPO301:是一款靶向表皮生长因子受体(EGFR)的ADC,在临床前毒理学和安全药理学研究中并显示良好的安全性和耐受性。临床前数据显示,CPO301能够剂量依赖性地抑制免疫缺陷小鼠中的各种EGFR激活突变,或野生型EGFR高表达模型的人类肿瘤的生长;在三代EGFR-TKI奥希替尼耐药的EGFR三重突变(Exon19Del、T790M和C797S)的人源化非小细胞肺癌PDX模型中,显示出很强的抗肿瘤效果。2023年6月,该药物获得FDA授予快速通道资格。
SYS6010:是一款靶向EGFR的单克隆抗体偶联药物(ADC),可与肿瘤表面的特异性受体结合,通过内吞作用进入细胞、释放毒素,达到杀伤肿瘤细胞的作用。临床前研究显示该产品对多种癌症均显示较好的抗肿瘤作用。2023年4月,该药物获CDE批准开展临床,适应症为晚期实体瘤。
SYSA1801:是重组抗人CLDN18.2单克隆抗体-MMAE偶联药物,由1个抗CLDN18.2全人源单克隆抗体在每个重链Q295位氨基酸上偶联 1个 MMAE衍生物(LND002)构成,通过选择性结合于CLDN18.2受体环 I,在靶细胞内溶酶体降解释放出活性化疗药物MMAE,而发挥抗肿瘤作用。
2023年6月,公司在ASCO年会上公布了SYSA1801治疗CLDN18.2表达晚期恶性实体瘤患者的I期临床研究成果,结果显示:25例(75.8%)受试者发生与研究药物相关的不良事件(TRAE),其中8例(24.2%)发生3级及以上TRAE;21例受试者可评估疗效,其中包括17例胃癌受试者,胃癌人群的ORR和DCR分别为47.1%(95%CI 23.0-72.2%, 8PRs)和62.7%(95%CI 38.3-85.8%, 3SDs)。此外,有2例胃癌受试者的疗效格外亮眼,1例既往接受靶向CLDN18.2单抗治疗失败者在接受SYSA1801治疗后获得PR,另1例接受SYSA1801治疗后获得持久的PR,至截止日期时已经长达44周。
关于2023年国内ADC“出海”
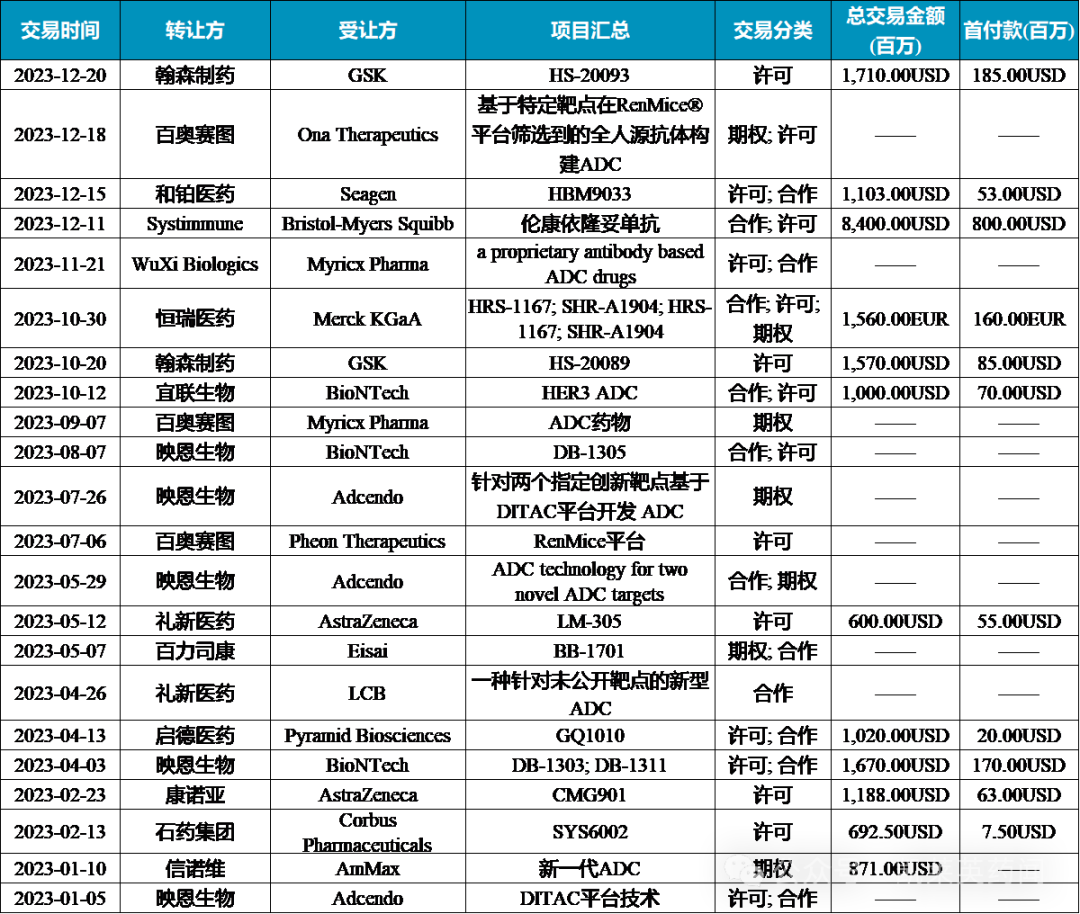
据不完全统计,2023年国内共发生ADC“出海”22笔,可统计总金额超21.5亿美元。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..