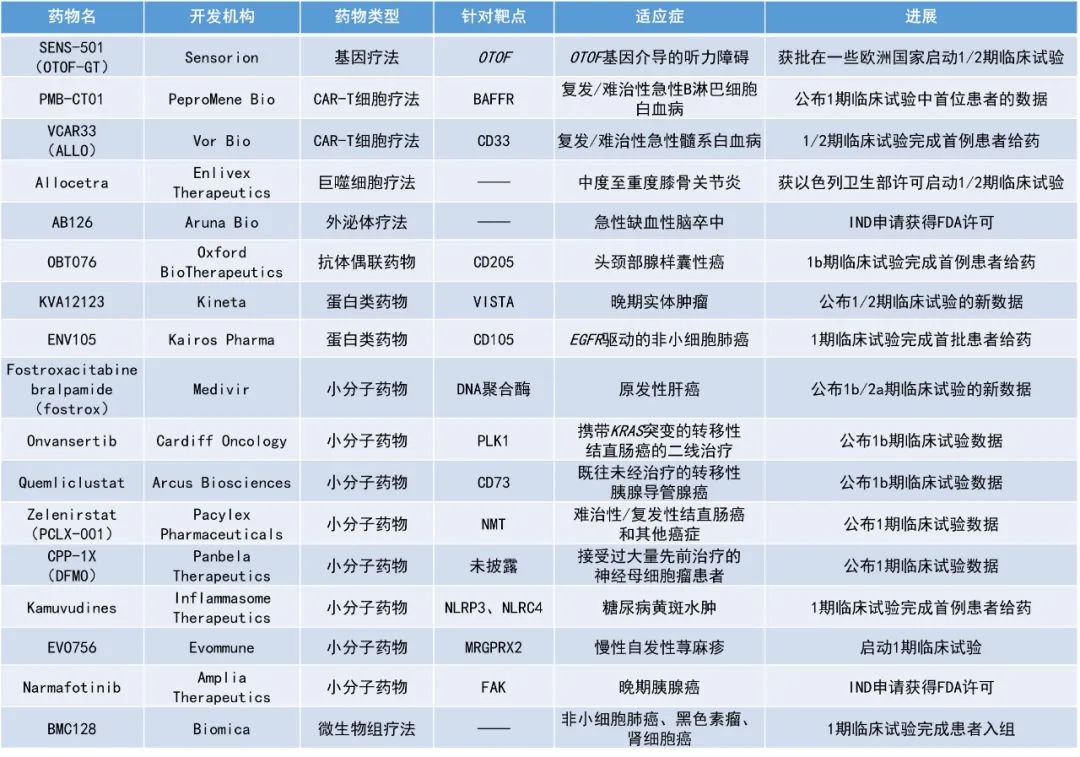
1. 一项1b期研究数据显示,基于CD73抑制剂quemliclustat的联合治疗方案在未经治疗的转移性胰腺癌患者中具有治疗潜力,患者的总生存期(OS)较单独化疗的历史基准数据延长5.9个月。
2. Panbela Therapeutics公司基于CPP-1X(DFMO)的联合疗法在神经母细胞瘤患者中展现积极疗效,3名完成治疗的患者在没有接受额外治疗的情况下,已保持4年多没有出现疾病进展。
3. Fostrox联用激酶抑制剂lenvatinib治疗晚期肝细胞癌(HCC)展现积极结果,18周时的疾病控制率(DCR)超过60%。
药明康德内容团队整理
Quemliclustat:公布1b期临床试验数据
Arcus Biosciences公司与吉利德科学(Gilead Sciences)公司公布了其共同开展的1b期研究ARC-8的OS数据。ARC-8是一项针对既往未经治疗的转移性胰腺导管腺癌(mPDAC)患者的研究,旨在评估一种在研小分子CD73抑制剂quemliclustat(下表中简称“Q”)+化疗(下表中简称“G/nP”)±一种在研抗PD-1抗体zimberelimab(下表中简称“Z”)的疗效。
截止2023年6月19日的数据,以quemliclustat为基础的两种治疗方案的中位OS为15.7个月,单独化疗组的历史基准数据为9.8个月。相比于单独化疗组,接受以quemliclustat为基础的两种治疗方案的患者的死亡风险降低了37%(HR=0.63;95% CI:0.47-0.85,p=0.0030)。安全性方面,未发现新的安全性信号。最常见的不良事件(≥3级)是中性粒细胞减少和贫血。
CPP-1X(DFMO):公布1期临床试验数据
Panbela Therapeutics公司公布了CPP-1X(DFMO)治疗神经母细胞瘤的临床研究数据。这项发表在British Journal of Cancer上的研究旨在评估大剂量CPP-1X与塞来昔布(celecoxib)联用标准化疗治疗接受过大量先前治疗的神经母细胞瘤患者的耐受性和活性。
结果显示,CPP-1X的耐受性良好,患者的中位进展时间(time-to-progression)为19.8个月。最佳总缓解包括2例部分缓解(PR)、4例轻微缓解(MR)、10例疾病稳定(SD)、7例疾病进展(PD)和1例无法评估的患者,无完全缓解(CR)患者。所有总缓解为PR或MR的患者都保持了这种缓解,直到停止或完成治疗。客观缓解率(CR+PR)为9%,任意缓解率(CR+PR+MR)为26%。2年后,该队列的无进展生存率为29.5%。值得注意的是,有3位患者完成了治疗,并且在治疗结束后的四年多时间里,在没有额外治疗的情况下,仍未出现疾病进展。
Fostroxacitabine bralpamide(fostrox):公布1b/2a期临床试验的新数据
Medivir公司公布了其正在进行的1b/2a期研究的积极新数据。该研究旨在评估fostrox联用激酶抑制剂Lenvima(lenvatinib)治疗目前一线或二线治疗无效或不能耐受的晚期HCC患者的安全性和疗效。Fostrox是一种核苷酸DNA聚合酶抑制剂口服前药,以肝脏为靶器官,旨在选择性将药物递送到肝细胞中治疗HCC,并将副作用降至最低。
该研究目前仍在进行中,约有超过40%的患者仍在接受治疗,仅有5%的人因不良反应而停用fostrox,需要减少剂量的人数也低于预期。该联合疗法的耐受性良好,没有新的、意外的安全事件。此次公布的结果显示,大多数患者都能持续获得临床治疗效果,治疗18周时的DCR高达61%,总缓解率(ORR)为25%,中位进展时间为5.1个月。截至目前,持续缓解时间最长的患者在接受治疗约17个月后仍保持着PR。
PMB-CT01:公布1期临床试验中首位患者的数据
PeproMene Bio公司公布了其候选CAR-T细胞疗法PMB-CT01治疗复发/难治性急性B淋巴细胞白血病(B-ALL)患者的1期临床试验中首位患者的数据。PMB-CT01是一种潜在“first-in-class”的B细胞活化因子受体(BAFFR)靶向自体CAR-T细胞疗法。BAFFR是肿瘤坏死因子(TNF)受体超家族成员,是BAFF的主要受体,几乎只在B细胞上表达。由于BAFFR信号能促进正常B细胞的增殖,而且似乎是B细胞存活所必需的,因此肿瘤细胞不太可能通过丢失BAFFR抗原来逃避免疫反应。这种独特的特性使BAFFR靶向的CAR-T细胞疗法具有治疗B细胞恶性肿瘤的巨大潜力。
BAFFR靶向的CAR-T细胞疗法是使用抗BAFFR scFv(单链可变区)抗体与包含CD3ζ和4-1BB的第2代信号转导结构域构建的。研究发现,BAFFR靶向的CAR-T细胞能在体外和动物模型中杀死人类淋巴瘤和白血病细胞。PeproMene Bio公司已从希望之城(City of Hope)获得与PMB-CT01相关的知识产权许可。此次公布的数据显示,首例患者对PMB-CT01的耐受性良好,只出现了轻微的在预期内的毒性反应,并在接受治疗一个月后达到了CR。
AB126:IND申请获得FDA许可
Aruna Bio公司宣布美国FDA已批准了其主导项目AB126的IND申请。该公司预计将于2024年上半年启动AB126治疗急性缺血性中风患者的1b/2a期临床试验。AB126是一种未经修饰的神经源性外泌体,天然具有穿越血脑屏障的能力。有证据表明,AB126具有抗炎和神经保护特性。新闻稿指出,AB126是首款进入人体试验阶段的针对神经系统适应症的外泌体疗法。
KVA12123:公布1/2期临床试验的新数据
Kineta公司公布了其正在进行的1/2期临床试验的最新进展,该试验评估了其新型在研VISTA阻断免疫疗法KVA12123在晚期实体瘤患者中的治疗效果。KVA12123是一种单克隆抗体疗法,需每周输注两次。通过将独特的表位结合与优化的IgG1 Fc区相结合,KVA12123单药在临床前模型中显示出强大的肿瘤生长抑制作用,且在临床试验中没有报告细胞因子释放综合征(CRS)。KVA12123已被证明能降低VISTA靶点的风险,并提供了一种新的方法来解决肿瘤微环境中的免疫抑制问题,其作用机制与以T细胞为重点的疗法不同且互补。
此次公布的结果显示,KVA12123的耐受性良好,单药或与帕博利珠单抗联用在任何剂量水平上都未出现剂量限制性毒性或细胞因子相关不良事件。此外,KVA12123单药可与给药剂量成比例地诱导强抗肿瘤活性所需的促炎生物标志物,显示了阻断VISTA的靶向作用。
Onvansertib:公布1b期临床试验数据
Cardiff Oncology公司公布了其polo样激酶1(PLK1)抑制剂onvansertib二线治疗携带KRAS突变的转移性结直肠癌(mCRC)患者的1b/2期研究结果。Onvansertib是一种潜在“first-in-class”的第三代口服高选择性丝氨酸/苏氨酸PLK1抑制剂,在各种实体瘤中作为单药或与多种化疗药物联合使用均显示出良好的耐受性。
此次公布的结果显示,onvansertib+标准疗法(SoC)化疗+贝伐珠单抗的组合疗法的安全性可控,疗效良好。在44%的患者中观察到PR,中位缓解持续时间为9.5个月。早期的循环肿瘤DNA(ctDNA)动力学可以预测治疗效果。这些积极数据促使Cardiff Oncology公司决定启动onvansertib一线治疗携带RAS突变的mCRC患者的临床试验。
Zelenirstat(PCLX-001):公布1期临床试验数据
Pacylex Pharmaceuticals公司公布了其N-肉豆蔻酰转移酶(NMT)抑制剂zelenirstat治疗复发/难治性结直肠癌和其他癌症的1期剂量递增的安全性和耐受性研究结果。Zelenirstat是一种潜在“first-in-class”的口服小分子NMT抑制剂,目前正在开发用于治疗白血病、淋巴瘤和实体瘤。在动物模型中,zelenirstat能在体外选择性地杀死癌细胞,并能使血液恶性肿瘤消退,抑制肺癌和乳腺癌的生长。在急性髓细胞性白血病模型中,zelenirstat能杀死白血病干细胞群,并使正常骨髓细胞再生和生长。
此次公布的结果显示,在推荐的2期剂量下,zelenirstat延长了胃肠道和其他癌症患者的无进展生存期。其中,一位此前曾接受过7线治疗后复发的晚期结直肠癌患者在接受了zelenirstat治疗后,癌胚抗原(CEA)和肿瘤体积减少了约50%。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..