1 月 16 日,据 NMPA 官网显示,齐鲁「伊鲁阿克」新适应症获批上市(受理号:CXHS2300042),据此前企业新闻稿,推测适应症为一线治疗 ALK 阳性NSCLC。

![]()
来自:NMPA 官网
伊鲁阿克片是由齐鲁制药自主研发的新型 ALK/ROS1 抑制剂,可抑制不同融合类型的野生型以及 ALK 抑制剂耐药突变的 ALK 激酶活性,同时可有效抑制不同融合类型 ROS1 激酶的活性。
这也是齐鲁制药申报上市的首款 1 类新药,具有里程碑意义。据 Insight 数据库,伊鲁阿克在 2016 年首次递交临床申请,2017 年首次在国内公示启动临床,2021 年 7 月首次申报上市,用于治疗既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性 NSCLC(受理号:CXHS2101032),并于去年 6 月获批上市。而此次获批新适应症。
伊鲁阿克全球项目开发进度概览
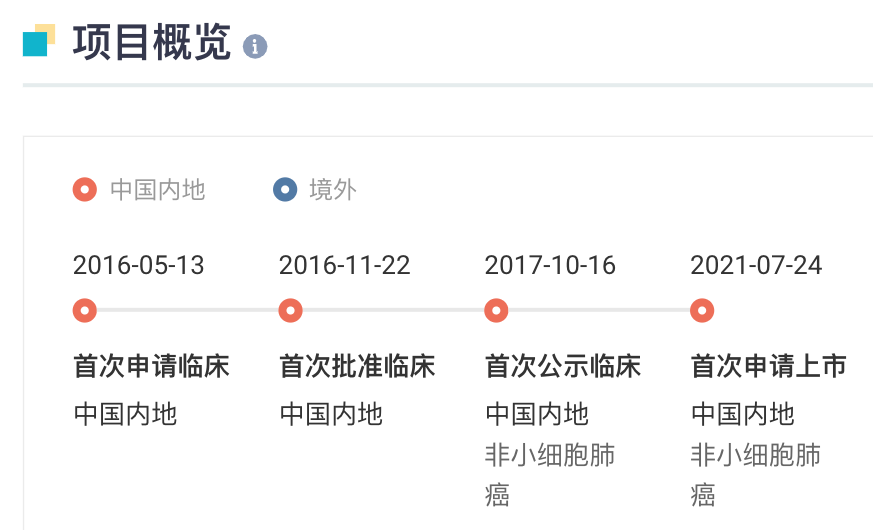
来自:Insight 数据库网页版 (http://db.dxy.cn/v5/home/)
伊鲁阿克 INSPIRE 研究是一项随机、开放、多中心的 III 期临床研究,旨在既往未接受过 ALK TKI 治疗的 ALK 阳性晚期非小细胞肺癌(NSCLC)患者中评价伊鲁阿克(口服 180 mg,每日一次;前 7 天导入期内为 60 mg 每日一次)对比克唑替尼(口服 250 mg 每日两次)的有效性和安全性。主要研究终点为独立影像评估委员会(IRC)评估的无进展生存期(PFS)。本研究的主要研究者是中国医学科学院肿瘤医院石远凯教授,研究在全国 40 家医院开展。
2019 年 9 月 4 日至 2020 年 12 月 2 日之间,共 292 例患者入组并接受治疗(伊鲁阿克组 143 例;克唑替尼组 149 例)。本次发表的研究结果是基于独立数据监察委员会(IDMC)审核的期中分析结果(期中分析数据截止日期:2022 年 11 月 13 日)。
伊鲁阿克组与克唑替尼组的中位随访时间分别为 23.98 个月和 24.54 个月。结果显示,主要研究终点 PFS(IRC 基于 RECIST v1.1)达到预设标准,伊鲁阿克组较克唑替尼组 PFS 显著改善,两组的中位 PFS 分别为 27.70 个月和 14.62 个月(风险比,0.344 [98.02% 置信区间 0.226-0.523])。在次要终点缓解持续时间(DoR)和颅内疾病控制上,伊鲁阿克组也显著优于克唑替尼组。在本研究中伊鲁阿克的安全性与伊鲁阿克既往研究安全性特征一致,安全性良好,较克唑替尼治疗未增加安全性风险。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..