国际第三方评价数据显示,我国新药研发水平已经从第三梯队跻身第二梯队。在这背后,既有多年来药物审批层面政策改革的助力,也离不开本土企业研发实力的提升。据不完全统计,受新冠疫情影响,近五年的创新药获批情况有所波动;截至目前,2023年NMPA批准的创新药数量是93个,较上一年大幅提升。
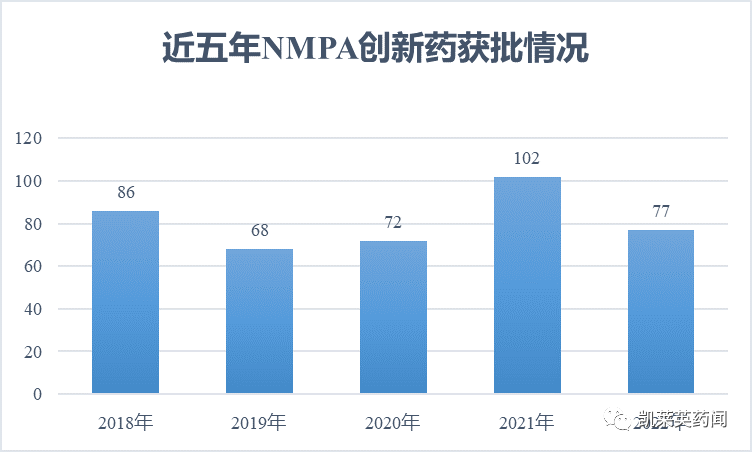
然而,国产创新药强势崛起,占据了新药获批的半壁江山;根据中商产业研究院分析师预测,2023年中国创新药市场规模将增长至7097亿元,2024年将达7534亿元。
本篇文章将对2024年有望在中国获批的国产创新药进行汇总,将按小分子化药、多肽、单抗、ADC、双抗、细胞疗法进行统计。

一
化药
1、恒瑞医药:艾玛昔替尼
作用机制:JAK1抑制剂
适应症:特应性皮炎
艾玛昔替尼(Ivarmacitinib,SHR0302)是一种JAK1抑制剂,属于2代JAK抑制剂,具有高选择性、高效和延长的血浆半衰期的特点,这样优化的特性旨在提供更大的治疗窗。它可通过抑制JAK1信号传导发挥抗炎和抑制免疫的生物学效应。2018年1月,恒瑞医药与Arcutis公司达成协议,将用于治疗免疫系统疾病的艾玛昔替尼项目有偿许可给后者;Arcutis获得艾玛昔替尼在美国、欧盟和日本的独家临床开发、注册和市场销售的权利。恒瑞医药最多可获得共2.23亿美元的首付款和里程碑款,外加销售提成。
2023年6月,硫酸艾玛昔替尼片治疗中重度特应性皮炎(AD)的药品上市许可申请获国家药监局(NMPA)受理。此次申报上市,是基于一项随机、双盲、安慰剂对照、国际多中心的III期临床研究(QUARTZ3研究)。QUARTZ3共入组336例12岁及以上中重度特应性皮炎受试者,是国内同类药物中唯一同时纳入青少年患者的研究。该研究达到了预设的主要研究终点:IGA应答和EASI-75应答的受试者比例。研究结果表明,与安慰剂相比,每日一次口服艾玛昔替尼8mg或4mg能够显著改善中-重度特应性皮炎患者的临床症状,快速控制瘙痒,清除皮损并提高生活质量。同时,长期疗效数据证明艾玛昔替尼8mg及4mg能有效维持IGA及EASI-75 的应答。长期安全性数据显示两个剂量具有良好的安全性及耐受性。研究期间未发现新的安全性信号。
2、恒瑞医药:SHR8554
作用机制:μ opioid receptor激动剂
适应症:术后疼痛
SHR8554由恒瑞医药开发的一种小分子阿片受体μ亚型(MOR)偏爱性配体,拟用于疼痛的治疗。2022年7月,SHR8554的上市申请在国内获受理,该申请基于一项旨在评估SHR8554治疗腹部手术后镇痛的有效性和安全性的Ⅲ期临床数据,主要终点是使用11点(0-10)数字疼痛分级量表(NPRS)评估24小时疼痛强度,结果显示此项试验主要研究终点达到方案预设的优效标准。
3、迪哲医药:戈利昔替尼
作用机制:JAK1抑制剂
适应症:外周T细胞淋巴瘤
戈利昔替尼是全球首个且唯一针对T细胞淋巴瘤的高选择性JAK1抑制剂,可有效抑制JAK/STAT信号通路,目前正在中国、美国、韩国和澳大利亚等国家开展关键性临床试验。早前,戈利昔替尼用于治疗复发难治性外周T细胞淋巴瘤(r/r PTCL),于2022年获美国食品药品监督管理局(FDA)“快速通道认定”(Fast Track Designation)。2023年9月,戈利昔替尼的新药上市申请(NDA)获NMPA受理。
此次新药上市申请是基于其国际多中心关键性临床试验(JACKPOT8的B部分)。JACKPOT8研究分为两部分,A部分为剂量递增,B部分为剂量扩展。B部分r/r PTCL患者接受相应II期推荐剂量的戈利昔替尼,直到疾病进展或发生不可耐受的毒性。结果显示:IRC评估的ORR达到44.3%(39/88),其中21例患者(21/88,23.9%)达到完全缓解。在不同亚型中观察到肿瘤缓解,包括PTCL,NOS(23/50,46.0%)、AITL(9/16,56.3%)、ALCL(1/10,10.0%)、NKTCL(2/3,66.7%)等。缓解患者的中位随访时间为6.3个月,中位缓解持续时间(DoR)尚未达到,最长缓解时间达到16.8个月。
戈利昔替尼在r/r PTCL患者中表现出良好的耐受性。最常见的≥3级治疗相关不良事件(TRAEs)为血液学毒性,包括中性粒细胞计数降低(24.1%)、白细胞计数降低(23.2%)、血小板计数降低(17.0%)和淋巴细胞计数降低(16.1%)。中位治疗剂量强度100%,导致减量和停药的TRAEs分别为8.0%和6.3%。大多数TRAEs可逆或临床可管理。
4、海思科:crisugabalin
作用机制:GABA类似物
适应症:周围神经痛
Crisugabalin (HSK16149)是由海思科自主研发的新型电压门控钙离子通道α2δ亚基配体,可以α2-δ辅助蛋白结合发挥镇痛作用。临床前研究显示,HSK16149有很高的选择性,具有镇痛作用好,中枢系统安全性高等特点,有望成为慢性神经性疼痛潜在选择。2022年10月,HSK16149胶囊的NDA获NMPA受理,拟用于糖尿病周围神经痛(DPNP);2023年9月,HSK16149胶囊新适应症申报上市并获得受理,拟用于带状疱疹后神经痛。根据公开资料显示,HSK16149未来在临床应用中可能具有药效更显著、安全性更好等优势,具有成为慢性神经性疼痛首选用药的潜力。
5、泽璟制药:杰克替尼
作用机制:JAK抑制剂
适应症:骨髓纤维化
杰克替尼是一种新型JAK抑制剂类药物,属于1类新药,公司拥有该产品的自主知识产权。杰克替尼对Janus激酶包括JAK1、JAK2、JAK3和TYK2具有显著的抑制作用,且对JAK2和TYK2的抑制作用最强。另外,杰克替尼还可以通过抑制激活素受体1(ACVR1)活性,降低铁调素转录,改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血发生率和减少输血依赖。2022年10月,公司提交的杰克替尼片治疗中、高危骨髓纤维化适应症的NDA申请已获NMPA受理,成为第一个提交NDA的国产JAK抑制剂类创新药物。
2023年7月,杰克替尼治疗芦可替尼不耐受、芦可替尼复发/难治的中高危骨髓纤维化患者的两项II期临床研究同时被国际血液学领域顶级期刊《美国血液学杂志》正式接收。在杰克替尼用于芦可替尼不耐受的骨髓纤维化患者的安全性和有效性的IIB期临床试验(方案编号:ZGJAK006)和杰克替尼治疗芦可替尼难治或复发的骨髓纤维化患者的有效性和安全性的II期临床试验中,结果显示:
ZGJAK006试验中,共有44名芦可替尼不耐受的MF患者接受了盐酸杰克替尼片100 mg Bid的治疗,24周时,脾脏体积较基线缩小≥35%的受试者比例(简称SVR35)为43.2%;MF相关体质性症状评分改善50%及以上受试者的比例(TSS50)为61.8%;在基线血红蛋白≤100 g/L的输血非依赖的受试者中,有41.9%的受试者在治疗期间血红蛋白水平升高≥20 g/L。说明杰克替尼不仅具有非常好的有效性,而且总体安全性和耐受性良好。
ZGJAK017试验中,共计34名芦可替尼难治或复发的骨髓纤维化患者接受了盐酸杰克替尼片100 mg Bid的治疗。24周时,SVR35为32.4%;MF相关体质性症状评分改善≥50%的百分比(TSS50)为46.4%;在基线血红蛋白≤100 g/L的非输血依赖的受试者中,有50.0%的受试者在治疗期间血红蛋白水平升高≥20 g/L。受试者总体安全性良好,说明杰克替尼在治疗芦可替尼难治或复发的骨髓纤维化患者中,同样显示出优异的疗效和良好的安全性,具有同类药物最佳的潜质。
6、海创:德恩鲁胺
作用机制:AR拮抗剂
适应症:前列腺癌
德恩鲁胺(HC-1119)是公司自主研发的 1 类新药,是第二代雄激素受体(AR)拮抗剂恩扎卢胺的氘代药物。作为恩扎卢胺的氘代药物,氘代后药物代谢减缓,活性药物的暴露量增加,临床拟用剂量为恩扎卢胺的一半,用药依从性更好;目前已开展的临床研究中尚未观察到癫痫事件,与恩扎卢胺相比有较好的安全性。
2023年3月,德恩鲁胺的NDA已获NMPA受理,用于经醋酸阿比特龙或多西他赛治疗失败,不可耐受或不适合多西他赛治疗的转移性去势抵抗性前列腺癌(mCRPC)患者。该药物已完成 6 项I 期临床研究和 1 项 III 期临床研究,确证性临床试验数据统计结果显示,达到主要疗效终点,具有统计学意义。安全性统计结果显示,药物整体安全性均良好可控。
7、正大天晴:安奈克替尼
作用机制:c-Met/ROS1/ALK抑制剂
适应症:非小细胞肺癌
安奈克替尼是由正大天晴自主研发的1类创新药,作为新型小分子受体酪氨酸激酶抑制剂,对ALK,ROS1和MET基因突变均有较强的抑制作用。2023年6月,该药物用于既往未接受或接受过化疗治疗的ROS1融合阳性晚期NSCLC患者一线治疗的I/II期临床研究成果,全文在线发表于权威期刊《信号转导与靶向治疗》(影响因子:39.3)。结果显示:111例疗效可评估患者的ORR为80.2%(95% CI 71.5%,87.1%),其中1例完全缓解(CR)、88例部分缓解(PR)。其中109例患者的靶病变的体积较基线缩小,中位DoR为20.3个月(95% CI 11.0, 26.1)。观察到48例PFS事件,中位PFS为16.5个月(95% CI 10.2,27.0)(图2), 6个月PFS率达到83.2%(95%CI 74.6%, 89.0%),12个月PFS率达到53.8%(95%CI 42.7%, 63.6%)。在安全性上,不良事件主要是肝脏毒性和血液毒性,3级及以上不良事件发生率低,无3级或更高级别的眼毒性和神经毒性,治疗相关不良事件可通过减量或暂时用药及对症支持治疗控制,无治疗相关的死亡发生。
2022年6月,安奈克替尼的上市申请获NMPA受理,拟用于ROS1阳性的非小细胞肺癌。
二
多肽
1、派格生物:维派那肽
作用机制:GLP-1受体激动剂
适应症:2型糖尿病
维派那肽是派格生物自主研发的 1 类创新药物,属于长效GLP-1受体激动剂,在中国/美国已完成4项I期、2项II期、2项III期临床研究,结果显示良好疗效及安全性。此外,维派那肽注射液还具备无需滴定、每周一次、一次性预填充自动注射笔皮下给药等优势,显著改善患者用药依从性与生活质量。2023年9月,维派那肽注射液的上市申请获CDE受理,拟用于改善成人2型糖尿病患者的血糖控制。
根据2023年7月在美国糖尿病协会(ADA)年会公布的数据,维派那肽具备高效、强效降糖的特点,24周数据显著优于安慰剂组(p<0.001);4周治疗即显著降低空腹和餐后血糖,OGTT血糖曲线下面积大幅度降低,至第52周无反弹且降糖效果较24周更优。除了显著的降糖效果外,维派那肽注射液减重效果随着患者的体重增加而增大,在BMI >32患者中,52周平均降低4.77kg。此外,药物安全性良好,不良事件大多轻微且短暂,恶心和呕吐发生率分别为8%及5.1%,无2级(<3.0mmol/L)及以上低血糖发生。
三
单抗
1、康方生物:依若奇单抗
作用机制:抗IL-12/23p40单抗
适应症:银屑病
依若奇(AK101)是康方生物自主研发的新型人源化IL-12/1L-23 (白介素-12/白介素-23)单克隆抗体,IL-12及IL-23是炎症反应及免疫反应中自然产生的细胞因子,拥有共同的p40亚基,其中IL-12诱导Th1细胞(辅助性T细胞1)增殖并释放干扰素与TNF-α(肿瘤坏死因子α),IL-23诱导Th17细胞(辅助性T细胞17)发育并释放IL-17(白介素-17)等,这些细胞因子在炎性反应及免疫反应中起到促进或具有重要作用。依若奇通过靶向IL-12和IL-23的p40亚基并与之结合,同时抑制IL-12和IL-23与细胞表面受体的相互作用,进而减少T细胞对干扰素、TNF-α、IL-17等相关细胞因子的释放,阻断各自介导的细胞免疫反应。
2023年8月,依若奇单抗的上市申请获CDE受理,用于治疗中重度斑块型银屑病。针对中重度斑块型银屑病患者,依若奇单抗一共进行了5项临床研究,其中2项关键III期临床研究分别提供了依若奇单抗在中重度斑块型银屑病患者中的52周长期和16周短期的有效与安全性,结果显示:使用依若奇单抗治疗52周和16周疗效都很明显,安全性好。
2、康方生物:伊努西单抗
作用机制:抗PCSK9单抗
适应症:高胆固醇血症和混合性高脂血症
伊努西单抗(AK102)是康方生物与东瑞制药合资公司康融东方开发的创新PCSK9单克隆抗体,研究显示,在他汀药物背景治疗基础上使用PCSK9单抗,已证明可显著降低胆固醇,并降低患者心脏病发作或中风的发病率。基于四项关键注册性研究(包括一项52周针对疗效和安全性的双盲对照试验),公司已经向NMPA递交关于伊努西单抗注射液的两项适应症的新药上市申请,用于治疗原发性高胆固醇血症和混合型高脂血症,以及杂合子型家族性高胆固醇血症(HeFH)。
2023年5月,公司在2023年欧洲动脉粥样硬化学会大会(EAS 2023)上发布了伊努西单抗治疗原发性高胆固醇血症和混合型高脂血症患者的一项关键Ⅲ期研究成果。伊努西单抗450mg Q4W或150mg Q2W治疗12周均可有效降低LDL-C水平;同时可有效降低其他血脂参数包括血清总胆固醇(TC)、载脂蛋白 B(ApoB)、非高密度脂蛋白胆固醇(non HDL-C)水平,并呈现与LDL-C一致的趋势。其中:450mg Q4W组LDL-C较基线下降64.90%,较安慰剂组下降59.13%;150mg Q2W组LDL-C较基线下降66.21%,较安慰剂组下降60.43%。在安全性上,药物在原发性高胆固醇血症和混合性高脂血症患者中安全且耐受性良好,与同靶点已上市产品公开发表的安全性特征相似。
3、君实生物:昂戈瑞西单抗
作用机制:抗PCSK9单抗
适应症:高胆固醇血症
昂戈瑞西单抗(JS002)是君实生物自主研发的注射用重组人源化抗PCSK9单克隆抗体,用于治疗原发性高胆固醇血症和混合型血脂异常。2023年4月,国家药品监督管理局(NMPA)受理了昂戈瑞西单抗两项适应症的上市申请,用于治疗:1)原发性高胆固醇血症(包括杂合子型家族性和非家族性)和混合型血脂异常;2)用于成人或12岁以上青少年的纯合子型家族性高胆固醇血症。此外,本品在杂合子型家族性高胆固醇血症患者中的III期临床研究已完成入组。
2023年2月,公司宣布昂戈瑞西单抗在治疗原发性高胆固醇血症和混合型高脂血症的两项3期临床研究中均达到主要研究终点;其中,JS002-003研究是在原发性高胆固醇血症和混合型高脂血症患者中评价皮下注射昂戈瑞西单抗的有效性和安全性,JS002-006研究是在原发性高胆固醇血症和混合型高脂血症患者中评价使用两种给药装置[预充式注射器(PFS)和预充式自动注射器(AI)]皮下注射昂戈瑞西单抗的有效性和安全性。数据显示,昂戈瑞西单抗在两项研究中均表现出显著的降脂疗效,且安全性良好。
4、石药/和铂:巴托利单抗
作用机制:抗FcRn单抗
适应症:重症肌无力
巴托利单抗(HBM9161,batoclimab)同样是一款靶向FcRn的全人源单克隆抗体,可阻断FcRn-IgG相互结合,加速体内IgG的清除,从而达到有效治疗致病性IgG介导的自身免疫性疾病的效果。早期研究表明,巴托利单抗具有良好耐受性,可迅速降低多种自身免疫疾病患者体内IgG水平。2017年9月,和铂与HanAll签署战略合作协议,获得了巴托利单抗在大中华地区,包括中国大陆、香港、澳门和台湾开发的授权。2022年10月,和铂医药与石药集团全资子公司恩必普药业达成协议,在大中华区共同开发巴托利单抗。恩必普药业获得在大中华区(包括中国大陆、香港、澳门及台湾)开发、生产与商业化巴托利单抗的独家授权;和铂医药负责巴托利单抗在中国针对全身型重症肌无力的全完整临床实验的设计与执行, 并根据产品年度净销售额获得分层销售提成。
2023年6月,公司宣布巴托利单抗治疗gMG的III期临床试验取得积极研究结果,符合主要研究终点及关键次要研究终点;同时,其治疗总体上安全且耐受性良好,未发现新的安全性信号。同月,该药物上市申请获CDE受理,拟用于gMG。
5、石药/康诺亚:司普奇拜单抗
作用机制:抗IL-4Rα单抗
适应症:特应性皮炎
司普奇拜单抗(CM310) 是一种针对IL-4Rα的高效、人源化拮抗性抗体,其通过靶向IL-4Rα,双重阻断IL-4和IL-13 对IL-4Rα 的活化,从而阻断诱导II 型炎症的信号传导途径,治疗与II 型炎症相关的多种疾病,如II 型过敏性疾病,具体包括特应性皮炎、哮喘、慢性鼻窦炎及嗜酸性食管炎等。该药物由康诺亚开发,石药集团全资附属公司津曼特生物拥有于中国(不包括香港、澳门或台湾)开发及商业化CM310用于治疗中重度哮喘及慢性阻塞性肺疾病等呼吸道疾病的独家许可。2023年8月,依若奇单抗注射液的上市申请获CDE受理。
此前,公司宣布CM310重组人源化单克隆抗体注射液治疗中重度特应性皮炎(AD)的III期确证性临床研究已完成揭盲及初步统计分析,主要研究终点均成功达到,安全性特征良好,且与既往结果一致。另外,一项评价CM310在慢性鼻窦炎伴鼻息肉患者中的有效性和安全性的随机、双盲、安慰剂对照III期临床研究,并已于2023年5月完成了该III期临床研究的患者入组。除此,在中重度哮喘治疗开展关键II/III期临床研究,目前正在进行患者入组工作。
6、恒瑞医药:夫那奇珠单抗
作用机制:抗IL-17A单抗
适应症:斑块状银屑病
夫那奇珠单抗(vunakizumab,SHR-1314)是恒瑞医药研发的一种靶向人IL-17A的重组人源化单克隆抗体,与IL-17A结合后抑制下游细胞因子,阻断炎症信号传导。目前,Vunakizumab已在成人中重度慢性斑块型银屑病、成人强直性脊柱炎III期临床研究中证实可缓解疾病进展且安全性耐受性良好;此外,还在成人活动性银屑病关节炎、成人活动性中重度甲状腺相关眼病等多种自身免疫性疾病中开展II期临床试验研究。2023年4月,夫那奇珠单抗的药品上市许可申请获国家药监局受理,用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者。
在一项评价SHR-1314注射液治疗成人中重度慢性斑块状银屑病的疗效和安全性以及药代动力学的多中心、随机、双盲、平行、安慰剂对照的临床Ⅲ期研究中,结果显示,与安慰剂相比,SHR-1314对中重度斑块状银屑病具有统计学显著性和临床意义的改善,达到了主要研究终点及关键次要研究终点。同时,SHR-1314注射液在中重度慢性斑块状银屑病患者中长期治疗的安全性、耐受性良好。
7、恒瑞医药:瑞卡西单抗
作用机制:抗PCSK9单抗
适应症:高胆固醇血症
瑞卡西单抗(SHR-1209)是恒瑞医药自主研发的抗PCSK9的人源化单克隆抗体,通过与循环中的PCSK9结合,增加肝细胞表面LDLR的表达,促进LDL-C清除,从而达到降低血清LDL-C水平的目的。瑞卡西单抗给药频率更灵活,可为患者提供新的治疗选择。目前瑞卡西单抗共计已完成了多项临床研究,2023年6月,该药物的药品上市许可申请获NMPA受理,用于治疗高胆固醇血症患者。
该上市申请主要基于SHR-1209三项多中心、随机、双盲、安慰剂平行对照的III期临床研究(SHR-1209-301/302/303)。三项研究主要终点均达到方案预设的优效标准,与安慰剂相比,可明显降低原发性高胆固醇血症(包括杂合子型家族性和非家族性)和混合型高脂血症患者的低密度脂蛋白胆固醇(LDL-C)水平。同时,SHR-1209在原发性高胆固醇血症(包括杂合子型家族性和非家族性)和混合型高脂血症患者中整体的安全性和耐受性良好,三个剂量组之间安全性相当。
四
ADC、双抗
1、科伦:trastuzumab botidotin
作用机制:靶向HER2 ADC
适应症:HER2阳性乳腺癌
Trastuzumab botidotin (A166)是科伦博泰研发的靶向HER2的创新ADC,能够靶向HER2表达的肿瘤细胞,通过内吞作用进入细胞后,在胞内溶酶体中被切割并释放毒素分子,从而高效杀伤肿瘤细胞。A166兼具抗体药物的靶向性以及化疗药物的高杀伤性等特点。在HER2阳性乳腺癌中,A166用于经过二线及以上抗HER2治疗的Ⅰ期拓展研究显示,ORR为73.9%。2023年5月,公司向CDE提交了A166的上市申请,适应症为既往经过二线及以上抗HER2治疗失败的HER2阳性不可切除的局部晚期、复发或转移性乳腺癌。
2、康方生物:依沃西单抗
作用机制:靶向PD1/VEGF-A双抗
适应症:非小细胞肺癌
依沃西单抗(AK112)基于康方生物独特的Tetrabody 技术设计,可阻断PD-1 与PD-L1 和PD-L2 的结合,并同时阻断VEGF 与VEGF 受体的结合;鉴于VEGF和PD-1 在肿瘤微环境中的共表达,与联合疗法相比,AK112作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。2022 年12 月 ,康方生物宣布授予Summit于美国、加拿大、欧洲和日本的开发和商业化依沃西的独家许可权;康方生物保留依沃西除以上地区之外包括中国的开发和商业化权利。
2023 年5 月,Summit宣布,依沃西(AK112/SMT112)联合化疗用于经第三代EGFR-TKI 治疗进展的EGFR突变、局晚期或转移性非鳞状非小细胞肺癌(NSCLC)的国际多中心III 期临床研究(HARMONi 研究),已在美国完成首例患者给药。此外,在依沃西单抗联合含铂化疗对比PD-1抑制剂联合含铂化疗一线治疗鳞状非小细胞肺癌(NSCLC)的Ⅲ期临床中,显示依沃西联合化疗总体安全性良好,且鳞癌受试者未见与贝伐珠单抗相关的出血风险,耐受性好。2023年8月,公司已向CDE提交上市申请。
五
细胞疗法
1、科济/华东:泽沃基奥仑赛
作用机制:靶向BCMA CAR-T
适应症:多发性骨髓瘤
泽沃基奥仑赛(CT053)是一种用于治疗复发/难治多发性骨髓瘤的全人抗自体BCMA CAR-T细胞疗法。该药物于2019年获得FDA的再生医学先进疗法(RMAT)及孤儿药称号,于2019年及2020年获得EMA的优先药物(PRIME)及孤儿药产品称号,于2020年获得国家药监局的突破性治疗药物品种。目前,泽沃基奥仑赛注射液基于在中国开展的LUMMICAR STUDY 1研究的NDA已被NMPA受理,在北美开展的LUMMICAR STUDY 2正在进行中。
2022年10月,科济药业已向NMPA提交NDA,用于治疗多发性骨髓瘤。2023年1月,科济宣布与华东医药就泽沃基奥仑赛注射液达成商业化合作;根据协议条款,科济药业将获得2亿人民币的首付款,并有权获得最高不超过10.25亿人民币的注册及销售里程碑付款。科济药业将继续负责泽沃基奥仑赛注射液在中国大陆地区的开发、注册和生产。
根据2022 ASH公布的数据,共有102例R/R MM患者接受了剂量为150×106 CAR+T细胞的泽沃基奥仑赛注射液治疗。结果显示:I期14例患者的结果表明,总缓解率(ORR)为100%,完全缓解/严格意义完全缓解率(CR/sCR)为78.6%。102例患者的中位随访时间为9个月,ORR为92.2%,VGPR及以上缓解的比率为85.3%,CR/sCR的比率为45.1%。在9个月的中位随访中,DOR率为86.1%,PFS率为84.6%。在达到VGPR及以上缓解的患者中评估了微小残留病(MRD),达到CR/sCR患者的MRD(<10-5)阴性率为100%,VGPR及以上缓解的患者比率为96.3%。在安全性上,泽沃基奥仑赛注射液耐受性良好,安全性可控。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..