根据最近一篇对突破性治疗认定(BTD)许可和拒绝的分析显示,美国 FDA 对其在 2017 年至 2019 年间拒绝了 60% 非肿瘤产品 BTD 请求背后的原因提供了内部观察。
FDA 药品审评与研究中心(CDER)官员 Atasi Poddar、Miranda Raggio 和 John Concato 于 2023 年 11 月 5 日在《治疗创新与监管科学》上发表的一篇题为“2017-2019 年非肿瘤topping治疗认定请求的决定”的论文中,解释了 FDA 为何拒绝这些 BTD 请求。
FDA BTD 计划旨在促进和加快研究性药物的开发,以满足未竟医疗需求。文章指出,研究的目的是提供关于 FDA BTD 请求审查流程的最新信息。研究审查了 CDER 从 2017 年 1 月 1 日到 2019 年 12 月 31 日期间批准或拒绝非肿瘤药物或生物制品(“药物”)突破性治疗指定请求的决定。
研究发现,在 240 项请求中,93 项(39%)请求获得许可,147 项(61%)请求被拒绝。表 1 显示了按治疗领域划分的 BTD 决策总结,包括肺科、过敏科和风湿科 (14%);皮肤科和牙科(13%);精神病学(13%);神经病学(12%);胃肠病学和先天性缺陷(10%);以及心脏病学和肾病学(9%)
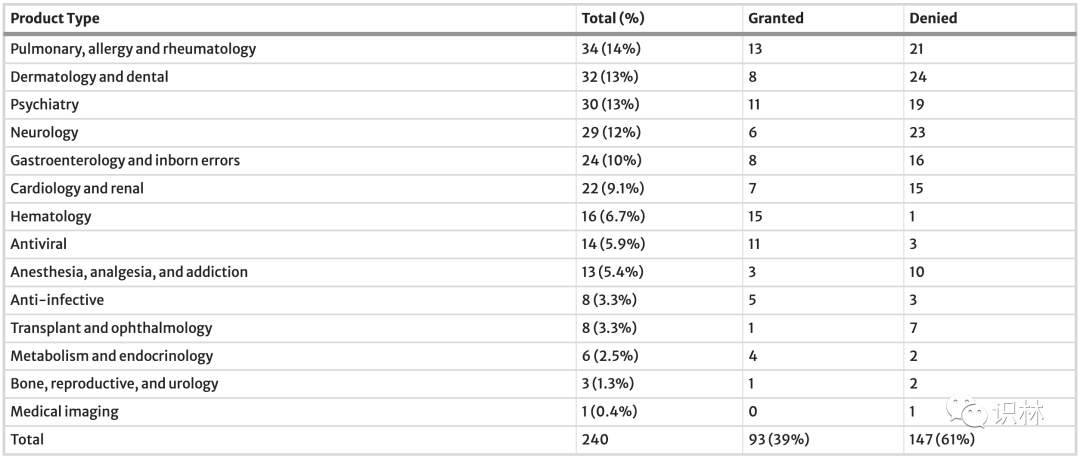
拒绝的常见原因包括数据相关问题、治疗效果不足、研究设计不当、终点属性、安全性问题以及对事后分析的依赖(见下表)。FDA 2016 年的一项先前分析发现,约由 50% 的 BTD 请求被拒绝,这项分析包括肿瘤药物。

作者指出,当申办人提交 BTD 申请时,CDER 的新药办公室将首先确定该药是否符合认定的基线标准,然后在医疗政策和计划审查委员会(MPPRC)审查各部门的决定之前,由相应的审评部门对认定请求进行审查。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..