中国药物临床试验登记与信息公示平台官网公示,Abivax公司已经在中国启动两项obefazimod(ABX464)治疗中度至重度溃疡性结肠炎的国际多中心(含中国)3期临床研究。公开资料显示,obefazimod是一款口服、具有“first-in-class”潜力的小分子药物,拟开发用于治疗溃疡性结肠炎。
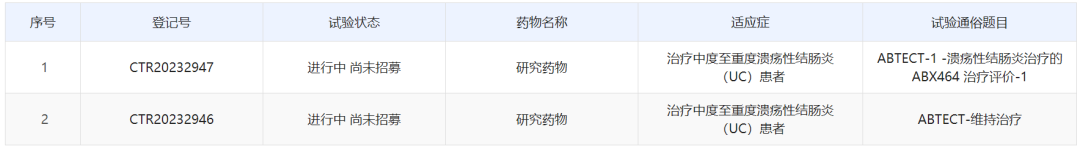
截图来源:中国药物临床试验登记与信息公示平台官网
溃疡性结肠炎(UC)是一项造成肠胃道慢性发炎的疾病,属于炎性肠病(IBD)的一种。患者可能会有的症状包含腹泻、腹痛、血便、直肠出血、体重下降与疲劳。溃疡性结肠炎影响全世界数百万人,此病严重影响患者的生活品质,他们也亟需更安全有效的口服疗法。
公开资料显示,Abivax公司专注于开发创新疗法,利用人体的自然调节机制来调节慢性炎症性疾病患者的免疫反应。Obefazimod是一款用于治疗溃疡性结肠炎的小分子药物,它能够通过上调一种独特的RNA剪接产物和抗炎因子miR-124的表达,进而抑制许多炎症反应介导物的生产,并在临床试验中显示出使UC患者缓解和“治愈”炎症病变的能力。
本次Abivax在中国启动的两项研究分别为:一项随机、双盲、多中心、3期研究,旨在中度至重度活动性溃疡性结肠炎受试者中评价obefazimod 25mg或50mg每日一次维持治疗的长期有效性和安全性;另一项为随机、双盲、安慰剂对照、多中心、3期研究,旨在中度至重度活动性溃疡性结肠炎受试者中评价obefazimod每日一次诱导治疗的有效性和安全性。这两项研究的中国主要研究者均为中山大学附属第一医院陈旻湖教授。
据Abivax公司公开资料介绍,obefazimod早先已经在临床2b期诱导治疗研究中达成主要终点。在该研究中,254位入组患者以一天一次的obefazimod(25mg、50mg、100mg)治疗,在试验8周时,该研究于调整后的Mayo评分(溃疡性结肠炎症状严重程度指标)上达成统计学上的显著下降,并在内镜检查、临床缓解等所有次要终点上,与安慰剂组相比呈现显著的改善。
2022年11月,obefazimod治疗溃疡性结肠炎的2b期诱导试验和48周延长试验结果发表在《柳叶刀-胃肠病学和肝脏病学》(The Lancet Gastroenterology & Hepatology)上。在完成2b期诱导研究的所有患者中,97.7%(n=217/222)的患者无论诱导期治疗结果如何,都参加了开放标签维持研究,以评估obefazimod长达两年的长期安全性和有效性。其中,49名患者进入维持研究时已经临床缓解,73.1%(n=38)在第一年保持临床缓解,67.3%(n=33)在维持治疗的第二年也保持缓解;而在诱导期结束时没有表现出基本临床反应的患者,在治疗两年后的临床缓解率为43.0%(n=40),表明长期服用obefazimod也为这些患者提供了实质性的临床益处。
据Abivax公司官网介绍,来自36个国家和地区的1200名中重度溃疡性结肠炎患者将参加obefazimod的关键3期临床研究,包括两项诱导研究和一项后续维持研究。在与包括美国FDA、中国国家药监局药品审评中心(CDE)在内的监管机构协商后,obfazimod 25mg和50mg将在3期研究用于治疗溃疡性结肠炎患者,以支持未来提交上市许可。
参考资料:
[1]中国药物临床试验登记与信息公示平台官网. Retrieved Oct 12,2023, From http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
[2]Abivax公司官网. From https://www.abivax.com/pipeline/abx464-ibd-uc/
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..