近日,国家药监局发布了最新一次的国抽质量公告,共计22批次药品抽检不合格(详见:国抽 !22批次药品不合格);
本以为此次公告没有什么特殊之处,但是当看到标示为一家药企生产的7批次血府逐瘀片不符合规定,不符合规定项目为鉴别时,还是很诧异,诧异的原因为:
1、血府逐瘀片印象中这应该是一个老品种了,7批次被抽检鉴别不合格,那之前生产的合不合格?这是要被罚破产的节奏啊;
2、同一品种七批次鉴别不合格,这是假药啊,生产这么多假药企业是怎么检验和放行的,质量负责人、受权人、QC负责人情何以堪?质量受权人是否瑟瑟发抖?
01品种上市时间不足3年
本来想看看到底是什么项目鉴别不合格,查询了下药典发现,血府逐瘀片不是药典收录品种,药典中收录的是血府逐瘀胶囊剂、合剂和丸剂,于是查询了下国家局数据库,结果也是让人很惊讶:
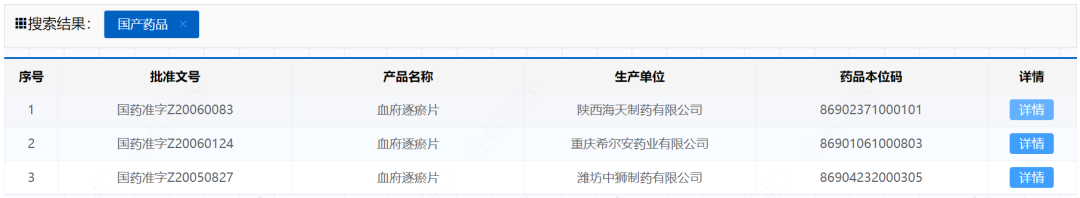
目前一共有3家企业持有该品种,且全部为2020年中旬左右获批的,除去企业拿到文号准备上市前的GMP符合性检查及整改等时间,该品种在市面上的理论流通时间也才不足3年。
本次抽检不合格,让笔者回想起了曾经历过的真实案例。
02更换检验试剂之后
某企业一个中药品种已经获批并商业化生产有近20年历史,但是在2019年的例行抽检过程中发现薄层鉴别不合格,且鉴别项药材在制剂处方占比为45%。
企业复检发现2017年之后生产的所有产品留样薄层鉴别皆不合格,但是产品放行时鉴别检验全部合格,经过梳理企业发现:
1、2017年企业为节约成本,检验所用的试剂整体更换了厂家,更换厂家后企业未按照变更管理,未使用新的试剂对2017年之前已放行批次留样进行结果比对;
2、因该产品属于老品种,一直未出现过问题,且药材入厂检验鉴别都没有问题,所以QC在初次检验成品鉴别斑点不清晰时未意识到问题的严重性,私自增加了超声时间和频率,导致鉴别结果失真,且随着时间推移QC慢慢的将实际超声时间、频率与批件不一致情况淡化,导致QC管理者也熟视无睹;
3、由于属于老品种一直未出现过不合格,QC存在检验数据造假行为,联系生产多批次只对一批次进行薄层鉴别检验,并用此批次检验结果代替其他批次上报检验结果;
4、由于产品属于老品种,检验方法开发结果存在漏铜,当药材相互混合后该鉴别方法的提取有效性容易受到溶剂的纯度影响。
基于以上几点,企业被迫暂停了该品种生产,启动了检验方法变更、召回了市面上所有在售产品,并重新申报了重大变更。
视线转回到这次国抽,试问,刚上市3年的药品为何大面积抽检不合格?
03偏差调查可从这几方面进行
带着以上疑问,我们根据猜想模拟下针对产品抽检不合格的偏差调查(以下猜想仅代表个人观点):
1、人员因素
可能原因:检验人员对检验方法不了解,造成鉴别检验结果失真;
原因分析:多批次不合格,检验人员不可能是同一人检验,人员操作失误的可能性基本可以排除;
2、仪器设备
可能原因:仪器出现故障,维修后无法达到真实检验水平,造成检验结果失真;
原因分析:存在这种可能性,如果原因成立那证明企业质量体系存在明显漏洞,对于仪器维修后的结果确认、数据可靠性管理缺乏足够的风险认知;
3、物料
3.1可能原因:企业使用了伪品药材进行投料,主观造假;
原因分析:不在分析范畴之内
3.2可能原因:更换了鉴别所用的溶媒试剂,未进行必要的变更管控;
原因分析:企业检验用试剂变更管理存在漏洞,未进行充分的风险评估,尤其是针对新获批的品种在不同品牌试剂间的检查差异性上未给与足够重视,导致检验结果失真;
4、法
可能原因:检验方法存在不足,造成检验结果失真;
原因分析:方法开发存在不足,针对药材混合后提取的有效性、回收率未进行充分的考察;
5、……
还有哪些可能的技术原因可能导致本次血府逐瘀片7批次鉴别不合格?
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..