9月14日,Iovance Biotherapeutics称,由于资源限制(Resource Constraints),FDA需要更多时间来完成对肿瘤浸润淋巴细胞(TIL)疗法lifileucel生物制品许可申请(BLA)的优先审查。该BLA旨在加速批准lifileucel用于晚期黑色素瘤患者的治疗。
FDA将根据PDUFA做出决定的新目标行动日期延长至2024年2月24日,但同意与Iovance合作加快剩余的审查工作,以争取更早的批准日期。
整个BLA程序继续处于优先审查阶段,最近更新了几个积极的状态。Iovance表示,FDA重申没有重大审查问题,也没有召开咨询委员会会议的计划。此外,对临床研究机构、内部和外部生产和测试设施的所有批准前检查均已顺利完成。FDA还参与了TILVANCE-301一线晚期黑色素瘤确证试验,并对该试验的进展情况没有表示任何担忧。
就此话题,同写意采访了前FDA资深审评官、埃格林医药CEO杜新博士。在他看来,FDA所谓的“资源限制”需要大家准确把握。
首先,FDA把预定的PDUFA行动日期从11月25日推迟到2024年2月24日,正好是3个月,在FDA正常的推迟审批的时间之内,这也证明FDA没有取消这个BLA优先评审(Priority Review)的资格。如果取消优先评审,评审时间应该从6个月降到10个月,即2023年3月24日。
其次,FDA是在这个BLA后期评审会议上通知申报方这个决定。后期评审会议属于BLA评审过程中非常关键的一个环节,通常是FDA做最后决定的时刻。
最后,也是最重要的一点,FDA提出推迟的理由是“没有足够的资源”来评审申报方针对FDA预定在9月11日举行的后期评审会所需信息的回复。也就是说,这个回复的内容超过了FDA在原有资源和原定时间内完成评审的能力。
FDA使用“资源限制”理由来推迟评审终点的例子并非鲜有,特别是在评审后期,申报方提供了新的信息或过多的信息,FDA的这个理由既合理又合情,也比较容易被申办方接受。FDA使用“资源限制”的理由来推迟评审终点的背后,可能有两种原因,一是FDA的的确由于人手不够,无法在原定期限内完成评审;二是可能FDA认为申报的BLA有较大的问题或缺陷,FDA需要更多时间来处理解决。

从Iovance的新闻看,FDA表示评审中没有重大的缺陷问题,所以杜新博士认为,这次评审终点的推迟可能是申报方在评审后期提供的回复所致。
在手持优先审查、再生医学先进疗法(RMAT)两张王牌,加上批准前检查(Pre Approval Inspection)已经完成的情况下,Iovance的评审终点被推迟3个月,尽管目前来说对最终完成评审没有太大影响,但损失还是不少。这件事也值得大家借鉴,在准备和申报BLA的时候,一定要熟悉评审流程、关键点以及补充信息的量和度,只有这样才能确保BLA的顺利申报和按时完成。
Iovance临时总裁兼CEO Frederick Vogt表示,仍对lifileucel的获批充满信心。作为一种个体化疗法,lifileucel适用于既往接受过抗PD-1/L1疗法和靶向疗法或之后病情进展的晚期黑色素瘤患者。在这种治疗情况下,目前还没有FDA批准的疗法。
这意味着,lifileucel一旦获批,将成为首个也是唯一一个用于晚期黑色素瘤患者的TIL疗法,同时也是首个用于实体瘤癌症的一次性细胞疗法。
Iovance原计划在2020年提交lifileucel的BLA,然而2019年10月召开的会议上,Iovance未能就lifileucel治疗转移性黑色素瘤所需的效力分析与FDA达成一致,受此影响,Lifileucel的上市申请计划从2020年底推迟至2021年。
2021年5月,FDA要求Iovance提供lifileucel效力分析的额外数据,以确保每一批TIL产品都符合标准。这使得lifileucel的BLA提交推迟至2022年,当时的CEO Maria Fardis也宣布离职。
FDA于2023年5月在优先审查下接受了lifileucel的BLA,并在此前授予了lifileucel治疗晚期黑色素瘤的RMAT称号。
lifileucel的BLA得到了C-144-01临床试验积极数据的支持,该试验针对的是既往接受过抗PD-1/L1疗法和靶向疗法或之后病情有所进展的晚期黑色素瘤患者,共分为4个队列,队列2的ORR为34.8%,mDOR尚未达到;队列4的ORR为28.7%,mDOR为10.4个月;队列2和4合并ORR为31.4%,mDOR尚未达到。
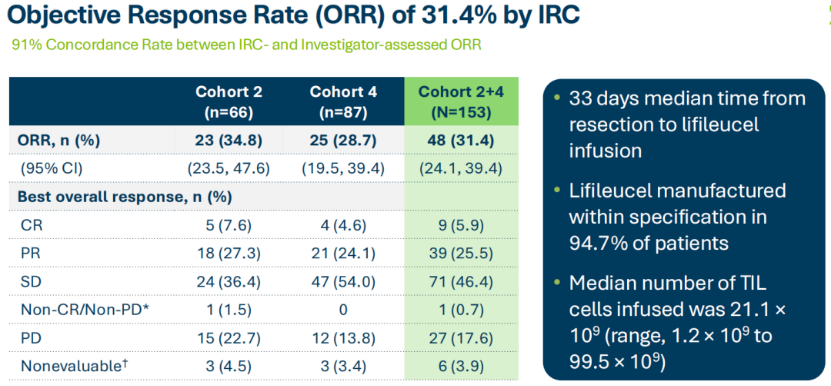
如果lifileucel获得加速批准,针对一线晚期黑色素瘤的随机III期TILVANCE-301试验可作为支持全面批准的确证研究。预计在获得批准时,TILVANCE-301试验将进展顺利。
除了lifileucel之外,Iovance开发的第二代TIL疗法LN-145近期也取得积极进展。7月10日,Iovance透露,在一次Type B III期临床前会议上收到FDA积极的监管反馈,IOV-LUN-202试验的设计可能被接受,用于加速批准TIL疗法LN-145作为PD-1抗体的后线治疗,用于晚期(不可切除或转移性)非小细胞肺癌。
7月13日,Iovance完成1.725亿美元的增发募资,以支持未来商业化工作以及临床开发和后续管线的推进。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..