引言:6月9日,在《2023抗肿瘤创新药物临床研究论坛》上,秦叔逵教授指出国内大部分医院临床研究能力不足,某些一年接400-500项临床研究的省级肿瘤医院,临床研究质量堪忧。
“现在的临床研究,不是数据造假,但因为医生的不参加、不主导、不控制,临床研究光靠CRC、CRA,总有一天会面临临床数据暴雷。特别是有些省级肿瘤医院,有两大问题,一是医生不做临床研究,将项目交给CRC、CRA进行临床试验;二是医院没有提供良好的临床试验场所,厕所、楼梯走道、电梯间走廊等,都可能成为他们的工作场所。”
“医生热衷于挂名,热衷于拿观察费和劳务费,不热衷于提高水平。临床研究界有可能再来一次“7·22风暴”。"
何为“722”风暴
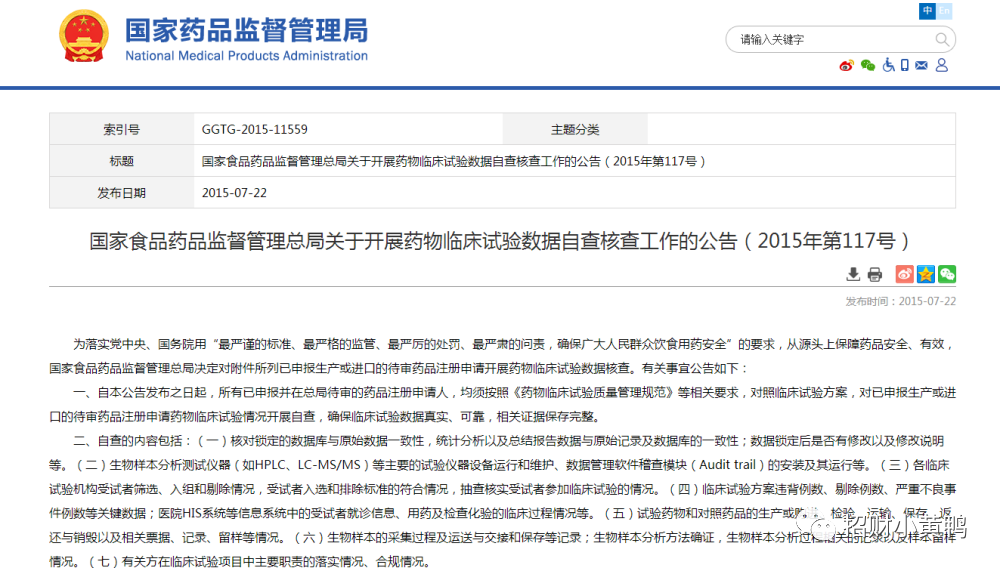
2015年7月22日,CFDA(现NMPA)发出临床试验数据核查公告(2015年第117号),组织对已申报生产或进口的待审药品开展临床试验数据自查核查工作。其中几个核心要点如下:
自本公告发布之日起,所有已申报并在总局待审的药品注册申请人,均须按照《药物临床试验质量管理规范》等相关要求,对照临床试验方案,对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,确保临床试验数据真实、可靠,相关证据保存完整。
自查的内容包括:核对锁定的数据库与原始数据一致性,统计分析以及总结报告数据与原始记录及数据库的一致性;数据锁定后是否有修改以及修改说明等。生物样本分析测试仪器(如HPLC、LC-MS/MS)等主要的试验仪器设备运行和维护、数据管理软件稽查模块(Audit trail)的安装及其运行等。各临床试验机构受试者筛选、入组和剔除情况,受试者入选和排除标准的符合情况,抽查核实受试者参加临床试验的情况。临床试验方案违背例数、剔除例数、严重不良事件例数等关键数据;医院HIS系统等信息系统中的受试者就诊信息、用药及检查化验的临床过程情况等。试验药物和对照药品的生产或购进、检验、运输、保存、返还与销毁以及相关票据、记录、留样等情况。生物样本的采集过程及运送与交接和保存等记录;生物样本分析方法确证,生物样本分析过程相关的记录以及样本留样情况。有关方在临床试验项目中主要职责的落实情况、合规情况。
国家药监局主要领导在发言中指出:药物临床试验中的问题比较严重,不规范、不完整的问题非常普遍,不可靠、不真实、弄虚作假的问题确实存在,已经严重影响了药品审批的正常进行。该公告要求1622个临床试验项目自查,如有问题主动撤回。如果在规定时间没有提交报告或撤回的,总局将进行飞行检查,一旦查出问题,“3年内不受理其申请”“吊销药物临床试验机构的资格”“列入黑名单”。
核查结果震惊世界!撤回和不予批准占比89.4%!!!
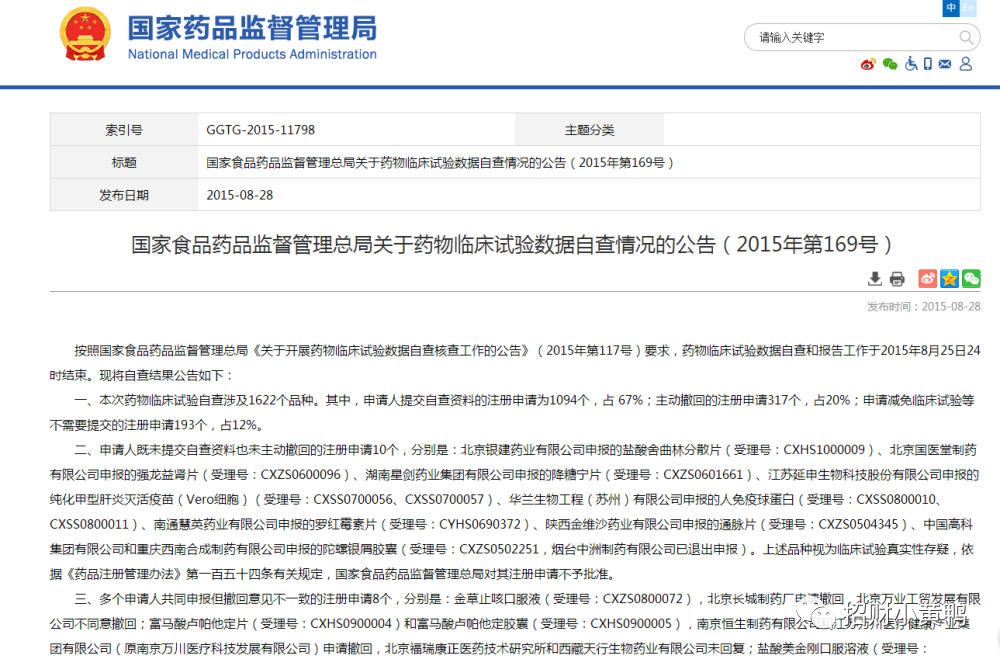
从“722”公告发布起,到2015年8月25日24时结束。本次药物临床试验自查涉及1622个品种。其中,申请人提交自查资料的注册申请为1094个,占 67%;主动撤回的注册申请317个,占20%;申请减免临床试验等不需要提交的注册申请193个,占12%。
截止到2015年12月31日,申请人主动撤回药品注册申请达 1009 个,涉及药品企业数百家。最终,撤回和不予批准的总数为1277个,占应当核查的比重为89.4%。
“722”事件让中国制药在世界上颜面扫地
“722”事件给制药行业带来了毁灭性的打击,经历了“722事件”,行业内的叫苦声,不绝于耳。更有甚言,这就是“一刀切”“挖祖坟”“诛九族”。借此“机会”,国外药企开始大肆进军中国市场,高昂的价格、傲慢的态度,使得整个医药产业乃至终端患者都颇为受伤。
“722”事件也带领中国制药业进入新的“春天”
以“722事件”为起点,近几年国家药监局出台了一系列利好政策,极大地调动了市场主体的积极性。2018年7月27日,国家药监局正式发布《关于调整药物临床试验审评审批的公告》临床试验审批制正式被默许制所取代。不到5个月后,国家药监局发布《关于化学药生物等效性试验实行备案管理的公告》,BE试验也由审批制改为备案制。
同年10月,CFDA公布了《中华人民共和国药品管理法修正案(草案征求意见稿)》,其中关于MAH制度的落实,极大地调动了持有人公司投入研发的积极性。
更大的惊喜,则来自于实实在在的产业主体。
随着国内医药产业发展环境不断改善,资本市场也将目光瞄向了医药产业。自2015年起,中国医药行业的融资额连续4年实现了50%以上的同比增长,2018年医药产业投融资总额更是达到了104.01亿美元的历史高点,得益于此,一大批拥有较好发展潜力的创新药研发型企业开始涌现。
与此同时,来自证券机构的利好新政亦是对生物医药产业青睐有加。2018年2月,港交所推出上市制度改革,允许从事医药(小分子药物)、生物制药和医疗器械(包括诊断)生产和研发,但尚未盈利或未有收益的生物科技发行人上市;2019年3月,上交所科创板上市规则正式落地,亦向六大重点领域未盈利企业敞开怀抱,生物医药产业位列其中。
“生物医药项目开发动辄都是几千万的大投入,如果没有长期持续、有实力的资本支持的话,发展是会受到很大限制的。无论是港交所新政还是科创板规则都对创新性生物医药公司有很大的吸引力。”彼时正在冲击科创板有关企业负责人如是说。
制度创新、资本加持,原本受“722”事件阵痛影响的中国药品研发产业开始明显回暖,市场活力得到进一步激发。根据CDE发布的数据显示,自2016年起CDE承办药品注册申请数量以每年超15%的速度递增,2019年更是破8000份大关,达到了8056份的历史峰值,其中1类新药申报数量为589个,创历年新高。
结语:如今回看“722事件”,其实质就是通过一场疾风骤雨般的“整风运动”,起到了避免审批积压的作用,此后一系列新政的出台为产业发展创造了良好的生态环境,造就了中国创新药产业的蓬勃发展。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..