对很多化药而言,参比是绕不开的门槛。5月24日,药品审评中心正式下发关于公开征求《关于无参比制剂品种仿制研究的公告(征求意见稿)》意见的通知。而这个后续最大的影响就是集采。对众多已经在医保但无参比制剂的品种,意见稿落地后,必将加速推动集采扩围。
重点内容摘要:对于参比制剂目录中未收载的品种,即无参比制剂品种,经评估如有临床价值,申请人可开展仿制研究。
1、申请人应充分评估拟申报药物的预期临床价值,并通过良好设计的临床试验证明其预期临床价值。
2、仿制药品质量不低于研究充分、上市基础好或在相应治疗领域市场份额较大的已上市品种。
3、申请人应按照相应的技术要求开展药学研究、预期临床价值评估和临床研究。
收到申请人申请后,药审中心应在 60个工作日内组织专家对药品预期临床价值进行评估,决定是否同意其开展临床研究等。符合要求的,发放临床试验通知书。
4、参照现行仿制药注册分类提出上市申请(三、四类)。药审中心应严格按照现行技术要求对仿制药申请开展审评,对于质量符合要求、有充足证据支持其预期临床价值的,予以批准。
5、临床价值评估
5.1 适应症定位明确,给药方案具体清晰,符合现阶段我国临床诊疗需求与实践;
5.2 该品种作为主流治疗药物被广泛使用,且具备不可替代性特征,如,相比于其他可选药物或治疗方法,该品种在疗效方面具有明显优势,或在特殊人群(如儿童、老年)使用中具有突出临床价值;
5.3 有足够研究数据支持对该品种在我国人群中开展临床试验的获益风险评估。
6、申请人完成临床研究后,应按照现行化学药品申报资料要求递交相关资料。获得的临床试验结果能够证明预期临床价值的无参比制剂品种,予以批准。不满足上述情况的,不予批准。
对于葡萄糖注射液、氯化钠注射液、维生素 B2、维生素B6,碳酸钙 D3 咀嚼片等基础输液、营养药可不再进行临床研究,上市产品质量符合现行技术要求,不低于研究充分、上市基础好或在相应治疗领域市场份额较大的已上市品种
维生素B6口服和注射剂已经有参比了啊!!!
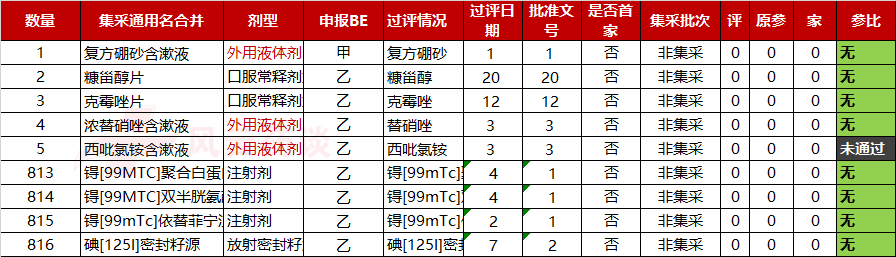
目前在医保目录,无参比制剂的(正式公布为准)品种有816个(按着集采通用名统计),明细如下:
来源:NMPA CDE 国家医保局
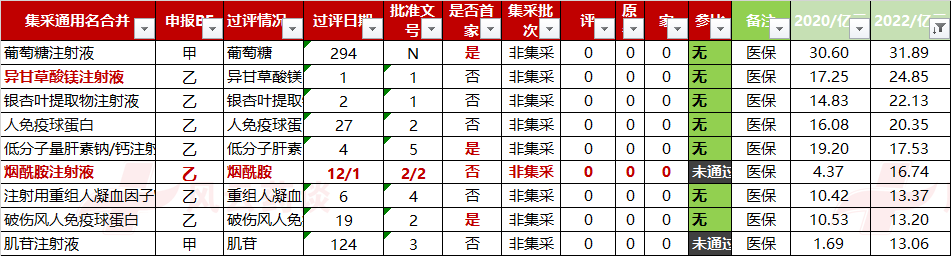
大品种也有不少,举例如下:
来源:NMPA CDE 国家医保局
总之,是个机会,看自己的选择吧。优先看难的、其次看不需要做大临床的,再看销售额大的。
来源:风云药谈、国家药审中心官网
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..