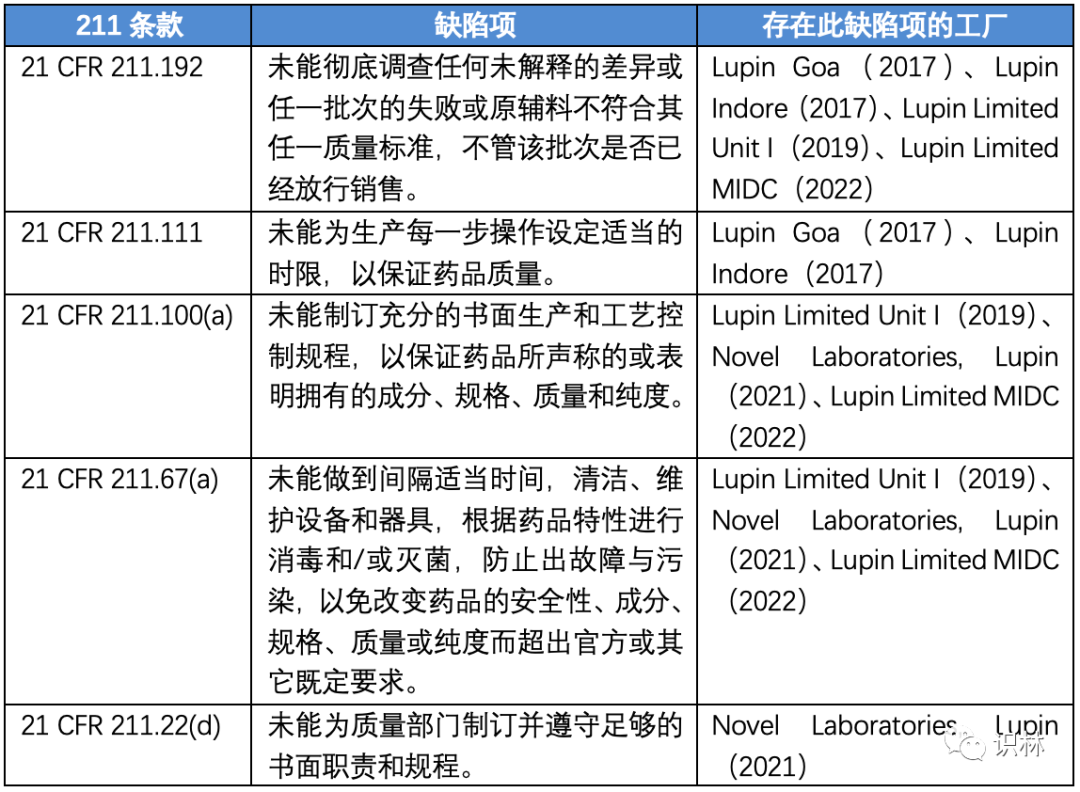
近年来印度Lupin公司成为了FDA警告信的常客,在三家印度工厂2017年和2019年收到警告信后,2021年,美国新泽西州的Novel Laboratories也收到了警告信。随后在今年9月,又一家印度原料药工厂(Lupin Limited MIDC)收到警告信。下表总结了Lupin各工厂近年来收到的警告信和其中所涉及的缺陷项。

下表将这几封警告信中重复出现的缺陷项进行了汇总。通过对比可以发现,FDA对于同一公司下的工厂,经常会发布类似的缺陷项,这一方面是由于同一集团下的工厂质量体系存在类似的问题,另一方面是由于FDA在检查前的准备工作中,往往会事先回顾该公司下的工厂以往检查中所涉及的缺陷项,这些缺陷项将是下一次检查的重点。这一理念也是FDA所一直强调的“使用基于风险的模型来决定接下来要检查哪些公司”。
重点缺陷项问题分析
细读各缺陷项下的细节描述,可以发现,Lupin各工厂的主要问题集中在两个方面:无效OOS和设备清洁验证,并且相似的缺陷项在各工厂的检查中反复出现。下文分析了无效OOS的主要问题和原因,对于清洁验证等更多细节问题的分析,可参见识林案例解析“印度Lupin Limited各工厂近年警告信分析”。
OOS调查和无效OOS
4家接受检查的工厂都出现了对超标结果(OOS)分析调查不充分,在没有确认根本原因的情况下关闭OOS调查,并以重新测试结果放行或拒绝批次,也未能实施有效的纠正和预防措施(CAPA)。
下表为FDA在2017年Lupin Goa的483中统计的无效OOS比例。商业化成品,一年中共有89次OOS调查,其中,通过调查将OOS无效的有67个,OOS无效率为75%;稳定性研究中共有31次OOS,经调查无效化的有30个,无效率高达97%;而对于原料,共有48个OOS,经调查无效化的有34个,无效率为71%。这意味着该企业避免向 FDA 发送现场警报:如果确认 OOS 结果,可能会触发批次召回。

极高的OOS无效化比例,有两种可能性,一是真OOS,但不想体现出来,所以,让人为错误、实验室错误来背锅。二是确实检验问题很大,人为错误层出不穷。因此,在解释了上述将OOS无效化的调查中存在的不足和问题以后,FDA在483中又汇总了一个关于OOS的培训汇总表(见下表)。

从表中可以看出:这里有3个是片剂溶出度不合格的OOS,另外两个是片剂含量均匀度的OOS。经无效化后,认定是检验人员的错误,于是,相应的整改措施,包括对人员进行培训。
汇总表里列出了该参加培训的人员数量,和实际被培训的人员数量。虽然具体数量未公开,但是在备注里汇总的注释包括以下3种情况:
培训没有针对所有实验室相关的检验人员进行;
同一检验员出现重复的检验错误,导致假OOS发生;
经过再培训的检验员,又出现重复的错误,导致假OOS发生。
而在上文中也提到,Lupin另外两家工厂在2019年和2022年的警告信中重复出现了此问题,说明此类问题一直没有得到有效的整改。多场地重复违规说明公司对药品生产的监管和控制不足,这些重复出现的问题也将是FDA今后对此公司下属工厂检查的关注点。印度Lupin的警告信对我国的制药企业也是一个警示,企业必须立足日常生产,对质量管理体系做主动、持续的改进,将偏差调查和CAPA落实到位,避免反复出现同样的问题。
作者:识林-雪杉
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..