目前,全世界约有7000多种罕见病,低磷性佝偻病是其中一种,被纳入《第一批罕见病目录》第51号罕见病。
X连锁低磷性佝偻病(XLH)是低磷性佝偻病的一种,约占遗传性低磷性佝偻病80%,具有较高的致残、致畸率,给患者的生长、活动能力和生活质量均造成巨大的影响。XLH是由X染色体内肽酶同源性的磷酸调节基因(PHEX)突变而引起多系统疾病。突变的PHEX基因干扰了成纤维细胞生长因子23(FGF23)的降解,导致在血液循环中FGF23升高,从而导致肾脏磷酸盐排泄增多,同时抑制了肠道磷吸收,最终造成低磷血症。
据介绍,XLH不但漏诊、误诊率高,临床治疗也面临诸多困境。以往临床多采用补充磷酸盐和活性维生素D的治疗方案,但此类治疗并非针对疾病病因,并需频繁用药(每日服用4-6次)及检测生化指标。关键是即使采用补“磷”方法,患者体内的血磷水平依然达不到正常水平,不能使变形的骨骼完全纠正,更难以改善患者生长发育迟缓的问题,治标不治本;还易引起肾结石、肾钙质沉着症、肾功能减退及继发性甲状旁腺功能亢进等并发症。
布罗索尤单抗(burosumab)是目前唯一被批准解决XLH潜在病因的药物,由日本协和发酵麒麟(Kyowa Hakko Kirin)和Ultragenyx Pharmaceutical公司联合开发,商品名为麟平/Crysvita,它能靶向结合并抑制FGF23的活性,抑制其下游信号通路,增加肾脏重吸收磷以及血清活性维生素D水平,促进肠道对磷酸盐和钙的吸收,提高血清磷水平,最终改善骨骼矿化和减少骨骼疾病。
2019年,布罗索尤单抗被纳入第二批《临床急需境外新药名单》;2021年1月,布罗索尤单抗获国家药品监督管理局(NMPA)批准上市;3月布罗索尤单抗扩展适应症,获得NMPA批准用于成人肿瘤性骨软化症,同年7月正式商业上市。
布罗索尤单抗作为全球首个靶向 FGF23 的全人源化单克隆抗体,被美国FDA授予突破性疗法认定和孤儿药资格。作为孤儿药,布罗索尤单抗在中国的市场如何?
根据弗若斯特沙利文分析,2020年中国孤儿药市场规模约为13亿美元,约占全球孤儿药市场规模的1%。预计到2030年,中国孤儿药市场规模将达到259亿美元,在全球孤儿药市场规模占比约7%。
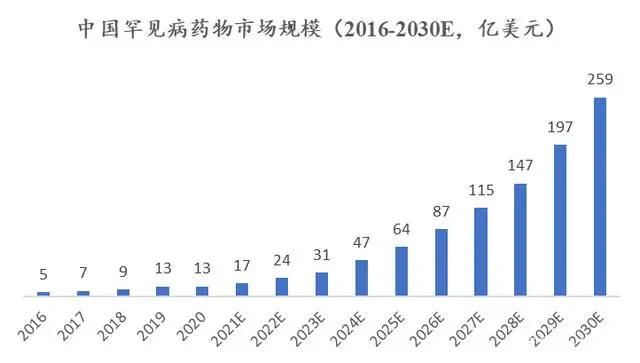
(来源:弗若斯特沙利文分析报告)
除此之外,根据弗若斯特沙利文和北京病痛挑战公益基金会联合发布的《2022中国罕见病行业趋势观察报告》显示,中国罕见病患者约2000万,且增长迅速。就总体人口规模及患病率而言,中国的罕见病患者总人数至少是美国市场的四倍。
患者人口基数与市场规模之间的差异证明国内孤儿药市场仍然存在巨大的发展空间与机遇。加上近年来,我国陆续出台罕见病相关的诊断、药物研发及注册、医疗保障、税收等多类型配套政策,进一步推动国内罕见病行业加速发展。为此,布罗索尤单抗在国内市场中亦不缺乏向好的契机。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..